Medicamentos
- 1. Medicamentos Benzodiacepinas (BZD) Actualmente se acepta que casi todas sus acciones son resultado de la potenciación de los efectos inhibidores del GABA (Acido Gama Aminobutírico). El neurotransmisor GABA aumenta la conductancia al Cl con la consecuente hiperpolarización de la membrana neuronal y por lo tanto inhibición de la transmisión del impulso y la respuesta. Tienen buena absorción por vía digestiva. Presentan variaciones cinéticas importantes según el compuesto. Son metabolizados en el hígado por los sistemas microsomales. La eliminación es fundamentalmente urinaria. Atraviesan la placenta y se excretan por leche materna. Cuadro clínico La toxicidad es un aumento de los efectos propios de la droga, en relación directa a la dosis. Laxitud, disminución de la capacidad de respuesta, ataxia, incoordinación, desorganización del pensamiento, confusión, disartria, amnesia anterógrada. Hipotonía generalizada, respuesta pupilar lenta. Con algunas Benzodiacepinas (Lorazepam) es común observar efectos paradojales, es decir inesperados: vómitos, rubicundez, irritabilidad y alucinaciones visuales además de ataxia. Cuando la ingesta se asocia a otro depresor, los efectos se potencian. Es particularmente grave el consumo de alcohol y BZD a dosis habituales, El diagnóstico puede certificarse solicitando Dosaje de Benzodiacepinas en orina. Tratamiento Las BZD son drogas seguras. El riesgo de vida en caso de sobredosis queda reservado a la asociación con otros depresores y menos frecuentemente a pacientes con enfermedad obstructiva crónica. En los pacientes con antecedente de ingesta y aún asintomáticos se practicarán métodos de eliminación. El Flumazenil ( Antagonista competitivo ) tiene aplicación terapéutica para revertir la sedación por BZD administradas en procedimientos pre-anestésicos, en coma por sobredosis masivas y valor diagnóstico en aquellos pacientes que ingresan en coma por causa desconocida y presuntamente tóxica. Barbitúricos Son depresores menos selectivos del SNC dado que además de su acción facilitadota sobre el GABA, deprimen las acciones de neurotransmisores excitadores y ejercen efectos no sináptico en la membrana. Se absorben bien por vía digestiva, comenzando el efecto entre 10 y 60 min. de acuerdo al compuesto. Se distribuyen ampliamente atravesando placenta y barrera hematoencefálica. Se eliminan por orina. Cuadro clínico Suele evolucionar en tres etapas 1ª Precomatoso: “Embriaguez barbitúrica”, lenguaje farbullante, somnolencia, vértigo, ataxia. 2ª Comatoso: Coma de profundidad dosis dependiente, en casos graves con silencio bioeléctrico transitorio, palidez o cianosis, hipotermia, miosis, bradicardia e hipotensión, bradipnea, hipoxia, acidosis metabólica. Hiperglucemia
- 2. 3ª Terminal: Profundización del coma, midriasis, muerte por colapso cardiocirculatorio, por complicaciones broncopulmonares o renales. Tratamiento Diuresis forzada alcalina. Si el paciente no responde a la terapia alcalinizante o presenta signos de insuficiencia renal aguda se indicará hemodiálisis o hemoperfusión. Está indicado realizar lavado gástrico aún en pacientes sintomáticos previa protección de la vía aérea. Restos del medicamento remanentes en estómago pueden prolongar y profundizar el coma incrementando el riesgo. Carbamazepina Características farmacológicas generales La carbamazepina fue sintetizada y estudiada como droga antiepiléptica entre los años 1950s y 1960s. Por entonces se describieron sus efectos antiepilépticos, psicotrópicos en epilépticos y antineurálgicos en síndromes paroximales. Como antiepiléptico demostró eficacia en las Epilepsias parciales simples y complejas, en las generalizadas tónico- clónicas, y en los patrones mixtos. No es eficaz para el tratamiento de las crisis de ausencia. La FDA la aprobó como antiepiléptico para adultos en 1974, para niños mayores de 6 años en 1978, y en 1987 como antiepiléptico sin restricciones según la edad(45). Los primeros reportes como drogas eficaces en los bipolares proceden de la literatura japonesa de 1971. No existe aprobación actual de FDA para los TB pero existe un grueso cuerpo de literatura que avala su uso, aunque con limitaciones. Estructuralmente se trata de un derivado iminostilbeno de estructura similar a la imipramina. Administrada por vía oral presenta una absorción lenta, errática e imprevisible. La concentración plasmática pico se alcanza en 4-8 hs. luego de su ingesta. La biodisponibilidad oral puede alcanzar el 85%. Los preparados de liberación prolongada producen concentraciones plasmáticas más estables. Presenta una distribución rápida con una unión a proteínas plasmáticas del 80% incluida la albúmina. Se biotransforma en forma completa a través del sistema del citocromo P450, produciendo metabolitos activos, mucho de los cuales presentan actividad antiepiléptica. El principal metabolito es el 10,11 epoxido, que representa el 50% de la concentración plasmática de la carbamazepina y posee actividad antiepiléptica y neurotóxica. La carbamazepina se inactiva por hidroxilación y conjugación con glucurónico. La vida media de la carbamazepina se encuentra en el rango de 18-55 hs., pero con la administración repetida se reduce a 20 hs. aproximadamente. Este fenómeno se estabiliza luego de 3 a 5 semanas. Se deben realizar estudios basales de la función hepática y hemática repitiéndose cada dos semanas los primeros dos meses y luego cada tres meses. Efectos adversos y toxicidad Presenta un perfil favorable en comparación al litio. No presenta el deterioro de memoria que éste presenta o los trastornos cognitivos de los barbitúricos o la fenitoína. Tampoco presenta aumento de peso, temblor o pérdida de cabello como lo hace el valproato. Sin embargo el 50% de los pacientes experimentan efectos adversos. Los más frecuentes son neurológicos como la diplopía, visión borrosa, fatigabilidad, nausea, vértigo, nistagmus, y ataxia. Estos son dosis dependientes y se contrarrestan reduciendo la dosis o efectuando la titulación de la misma en forma más lenta. Se describen como efectos menos frecuentes la leucopenia transitoria (10% de los epilépticos, 2.1% de los afectivos mayores), trombocitopenia transitoria, rash cutáneos (12% de los casos), hiponatremia e hipoosmolaridad, elevación asintomática de transaminasas ( hasta el 15% comparado con el 44% del valproato), leves polineuropatías periféricas y movimientos involuntarios. La leucopenia transitoria no se asocia con aplasia medular o
- 3. agranulocitosis, ni tampoco con infecciones. La leucopenia transitoria, la trombocitopenia transitoria y el aumento de las transaminasas se resuelven con la reducción de la dosis y/o con discontinuación En el caso del rash se sugiere discontinuar. La hiponatremia es más frecuente en ancianos y en aquellos que presenten niveles plasmásticos bajos de sodio al inicio. Por lo tanto, la aparición de nuevos síntomas mentales, como confusión, en el curso del tratamiento obligan a efectuar un ionograma. Este efecto constituye una indicación de discontinuación. Los efectos más serios son por idiosincrasia. Estos no se encuentran relacionados con la dosis, no son predecibles por estudios de laboratorio, y no guardan relación con la leucopenia, la trombocitopenia y la elevación de las transaminasas. Se describen discrasias sanguíneas (anemia aplásicas, agranulocitosis), falla hepática, dermatitits exfoliativa y pancreatitis. La mayoría ocurre dentro de los primeros 3 a 6 meses de tratamiento. Se debe educar a los pacientes sobre la presencia de síntomas hepáticos, dermatológicos o sanguíneos y sobre la necesidad de comunicarlos. Más raros son trastornos de conducción (incluyendo bradicardia o Stokes-Adams), síntomas psiquiátricos (manía o psicosis) y fallas renales (extremadamente raro). Los efectos teratogénicos se encuentran asociados a defectos en el cierre del tubo neural. La frecuencia de los mismos se reduce con la administración simultánea de folatos idealmente desde la concepción misma. Los signos tempranos de toxicidad son: vértigo, ataxia, sedación y diplopía La intoxicación aguda puede presentarse con hiperirritabilidad, estupor y coma. Los síntomas de sobredosis más frecuentemente reportados son nistagmus, oftalmoplegías, extrapiramidalismos, signos cerebelosos, deterioro del nivel conciencia, convulsiones y depresión respiratoria. Por su parecido estructural con la imipramina pueden presentarse arritmias cardíacas. También se reportan síntomas gastrointestinales y anticolinérgicos. La sobredosis puede ser fatal (dosis de 4 a 60 gr). Debido a su absorción lenta y errática los niveles tóxicos alcanzan su pico entre el tercer y cuarto día. Drogas antipsicoticas Los neurolépticos, también denominados drogas antipsicóticas o tranquilizantes mayores, constituyen desde su introducción a mitad de la decada de 1950, el principal tratamiento de la esquizofrenia, fase maniaca de los trastornos bipolares y alteraciones de la conducta. Actualmente, sus indicaciones clínicas van más allá del campo de la psiquiatría, estando indicados en el control de los vómitos, en el hipo intratable, y potenciando el efecto de otros fármacos como analgésicos y anestésicos generales. Debido a sus propiedades sedantes pueden ser utilizados previamente a la realización de algún procedimiento invasivo y en el área de urgencias para el control de los pacientes agitados. Además, se han utilizado en algunos cuadros neurológicos como corea, distonías, hemibalismo, espasmos, tics y torticolis. Recientemente, se han comenzado a utilizar como fármacos antiarrítmicos. La intoxicación puede producirse por la administración de dosis terapeúticas o bien por sobredosis accidental o con fines autolíticos. Así, se ha descrito la intoxicación de dos niños tras la administración tópica de una crema de prometacina. Aunque los casos mortales asociados con el uso terapeútico o sobredosis son poco frecuentes, sus efectos tóxicos sí lo son, y se pueden manifestar como síndrome anticolinérgico, síndrome extrapiramidal, síndrome neuroléptico maligno, alteraciones del sistema nervioso central y depresión cardiovascular. El uso terapeútico se ha asociado con infarto agudo de miocardio, apnea del sueño y muerte súbita tanto en el niño como en el adulto. Farmacologia y Farmacocinetica Actualmente, los neurolépticos se pueden clasificar en cinco grupos: fenotiazinas, tioxantenos, butiroferonas, indoles y difenzoxapinas . Su mecanismo de acción es
- 4. complejo y no se conoce del todo bien. Estos fármacos son bloqueantes de los receptores dopaminérgicos (subtipos 1 y 2), receptores de la histamina (subtipos 1 y 2), receptores alfa-adrenérgicos (subtipos 1 y 2), receptores muscarínicos y receptores serotoninérgicos. La actividad antipsicótica parece ser debida a la interferencia a nivel cortical, sistema limbico y ganglios basales de la neurotransmisión dopaminérgica y se correlaciona bien con la afinidad por los receptores-2 de la dopamina. Su acción antiemética y la capacidad para aumentar la secreción de prolactina también parece ser debidas a la inhibición de estos receptores a nivel de la zona trigger del hipotálamo. La disfunción hipotalámica puede ser responsable de los trastornos de la temperatura. Los efectos anticolinérgicos (taquicardia, hipotensión, ileo, midriasis, retención urinaria, sequedad de mucosas) se correlacionan bien con la actividad depresora del SNC e inversamente con la incidencia de reacciones extrapiramidales. Con respecto a las alteraciones cardiovasculares, la hipotensión es debido a un bloqueo adrenérgico alfa- 1, y se relaciona bien con el efecto sedante. Las fenotiacinas tienen también efecto anestésico local, antiarrítmico quinidinlike y son depresores miocárdicos. Los efectos cardiacos son dosis-dependientes, pero pueden ocurrir tanto a dosis terapeúticas como tóxicas. Los neurolépticos tienen una curva dosis respuesta bastante aplanada. Las dosis terapéuticas tienen un rango de valores muy amplios; así, la dosis óptima se determina por la respuesta terapéutica más que por los niveles séricos del fármaco. La mayoría de estos fármacos se absorben desde el tracto gastrointestinal de forma muy irregular, con un pico sérico que se produce de 2 a 4 horas después de la ingestión. Tras su absorción, los neurolépticos se fijan en un 90-99% a las proteinas plasmáticas. Sin embargo, debido a su alta liposolubilidad, tienen un volumen de distribución de 10 a 40 L/Kg, siendo sus niveles séricos después de una dosis terapéutica bastante bajos. Su vida media es larga, de 20 a 40 horas, son metabolizados lentamente por el hígado y una pequeña cantidad es excretada practicamente sin cambios por el riñon. A nivel hepático se producen una serie de metabolitos, algunos de los cuales son farmacológicamente activos (la mesodirazina es un metabolito activo de la tioridazina). Estos metabolitos son eliminados por la orina, y una cierta cantidad excretados por via biliar; pudiendo ser detectados en orina varios días después de una dosis terapéutica e incluso varios meses o más después de suspender un tratamiento crónico. En caso de insuficiencia renal, puede producirse un incremento de los niveles y de la toxicidad de estos fármacos. Cuadro Clinico Tras la ingestión los primeros síntomas que aparecen son náuseas y vómitos. Aunque, los efectos cardiovasculares y neurológicos son los que dominan el cuadro clínico. En los casos de intoxicaciones leves se observa ataxia, confusión, letargia, disartria, taquicardia e hipotensión. También se pueden observar síntomas anticolinérgicos (sequedad de piel y mucosas, disminución del peristaltismo intestinal) e hiperrreflexia. En el electrocardiograma se observan cambios, como alteraciones de la repolarización, aparición de una onda U ensanchada y prolongación del intervalo QTc. Asi, como, alteraciones de la conducción, arritmias supraventriculares y ventriculares como Torsades de Pointes y fibrilación ventricular. En los casos de intoxicación moderada se puede observar disminución del nivel de conciencia con un grado de coma bajo, depresión respiratoria e hipotensión sistólica. La miosis es frecuente, pero también se puede observar midriasis. Se ha decrito una oftalmoplejía internuclear, así como crisis de agitación, delirio, alucinaciones y psicosis.
- 5. En los casos graves, se produce coma profundo con pérdida de todos los reflejos, apnea, hipotensión y arritmias cardiacas. Alteraciones de la temperatura con hipotermia o bien hipertermia. Aunque el síndrome neuroléptico maligno es raro después de una intoxicación aguda, sí se puede observar hipertensión, hipertermia e hipertonia. La intoxicación por loxapina da lugar a un cuadro clínico atípico, donde los efectos cardiovasculares son leves o estan ausentes y en cambio se producen frecuentes convulsiones que pueden dar lugar a un cuadro de rabdomiolisis y fracaso renal. Las muertes que se producen de forma precoz se deben a arritmias, shock, aspiración o fallo respiratorio. Las complicaciones tardías incluyen edema pulmonar y cerebral, coagulación vascular diseminada, fracaso renal e infección. Se debe realizar una historia completa, interrogando al paciente y a las personas que lo acompañan. Y como en toda intoxicación hay que determinar el nombre, la cantidad, y el tiempo transcurrido desde la ingestión de la droga. En pacientes que toman de forma crónica neurolépticos y que acuden con signos de intoxicación, una medicación nueva o un cambio en la dosis puede ser el resposable de la intoxicación. Con respecto a las pruebas complementarias, debemos hacer un electrocardiograma de 12 derivaciones, gases arteriales y una radiografía de tórax y abdomen; en esta última podemos observar algunas densidades radioopacas en el tracto gastrointestinal que pueden ser debidas a intoxicación por fenotiacinas. En cuanto al análisis toxicológico de suero y orina por cromatografía o inmunoanálisis puede ser de utilidad para identificar la sustancia y descartar otras, aunque los niveles cuantitativos de drogas no son de utilidad para guiar el tratamiento. Síndrome extrapiramidal. Reacción distónica aguda. Las reacciones distónicas se caracterizan por un comienzo agudo, intermitente y repetitivo, con una exploración fisica normal excepto por los hallazgos musculares; existiendo el antecedente de ingesta de alguno de los fármacos que la pueden producir y responde rápidamente a la administración de fármacos colinérgicos. La contracción muscular a veces puede ser mantenida, pero lo habitual, es que dure solo segundos o minutos. El nivel de conciencia de los pacientes es normal. Aunque la distonía puede afectar a cualquier músculo estriado, lo típico es que afecte una de las siguientes cinco areas: Reacción distónica aguda que afecta a los musculos oculares (crisis oculógira), con desviación de la mirada hacia arriba, rotación de los ojos y espasmo de los parpados. Afectación de los músculos de la lengua y de la mandíbula con producción de trismus, protrusión de la lengua, disfagia, disartria y muecas faciales. Contracción de los músculos del cuello, con posiciones anormales de la cabeza. Afectación de los músculos de la espalda, dando lugar a posiciones que recuerdan el opistótono. Cuando se afectan los músculos de la pared abdominal el paciente puede presentar un cuadro de dolor abdominal. Los grupos musculares que con mas frecuencia se afectan son los bucolinguales y los del cuello. Aunque estas reacciones distónicas agudas no son mortales, cuando afectan a los músculos de la lengua, mandíbula, cuello y toráx pueden dar lugar a un compromiso de las vías aéreas superiores y alteraciones respiratorias de origen mecánico. Se han descrito algunos casos de muerte por fallo respiratorio. Acatisia Los pacientes se quejan de intranquilidad, nerviosismo y tensión, no pudiendo estar sentados ni de pie. En la exploración puede observarse movimientos no intencionados, sobre todo, de las piernas y de los pies, temblor y movimientos mioclónicos bruscos,
- 6. sobre todo de las extremidades inferiores. Como en el caso anterior, el diagnóstico se basa en la historia de la ingesta del fármaco y el examen físico. Parkinsonismo El pakinson inducido por drogas es indistinguible del de otra etiología, salvo por el antecedente de la administración de una serie de fármacos específicos. Se caracteriza por un incremento del tono motor (rigidez), disminución de la actividad motora (bradicinesia), temblor e inestabilidad postural. El temblor se produce de forma característica a nivel de antebrazos y manos, está presente en reposo y empeora con la agitación o la excitación, desapareciendo con el sueño. Los pacientes se quejan de fatiga, rigidez, dolores musculares e incoordinación. El diagnóstico se basa en la historia clínica y en el examen físico. Diagnostico Diferencial Las intoxicaciones por fármacos antiarrítmicos, anticolinérgicos, anticonvulsivantes, opiáceos, y agentes hipnótico-sedantes pueden producir un cuadro clínico similar al producido por los neurolépticos. Puede ser imposible distinguir una intoxicación por antidepresivos cíclicos de la intoxicación producida por tioridacina o mesoridacina sin un análisis toxicológico. Las infecciones del sistema nervioso central y los traumatismos tambien deben formar parte del diagnóstico diferencial. En caso de una reacción distónica aguda, el diagnóstico diferencial debe incluir las distonías primarias, convulsiones, accidente cerebro vascular, encefalitis, tetanos, hipocalcemia, intoxicaciones por drogas (fundamentalmente estricnina y fármacos anticolnérgicos), reacciones histéricas de conversión, meningitis, hipomagnesemia y alcalosis. En cuanto a la acatisia, ésta puede confundirse con diferentes estados de ansiedad o agitación relacionados con algún problema psiquiátrico de base. Con respecto al parkisonismo, debemos valorar otras causas como la encefalitis, traumatismos y tumores del SNC, accidentes vasculocerebrales. Ttratamiento La mayoría de los pacientes con intoxicación aguda por neurolépticos suelen permanecer asintomáticos y desarrollan sólo una intoxicación leve, por lo que no suelen requerir hospitalización. Los casos de intoxicación moderada pueden ser observados en el servicio de urgencias hasta que esten despiertos. Pero aquellos que presentan hipotensión, depresión significativa del nivel de conciencia, convulsiones o arritmias deben ser ingresados en una UCI. El tratamiento inicial es de soporte. Todo paciente requiere de una monitorización cardiaca y respiratoria. La intubación orotraqueal puede ser necesaria, bien para protección de la vía aérea o porque precise apoyo ventilatorio. En los pacientes con convulsiones o hipertemia es necesaria la monitorización de la temperatura. A los pacientes que presentan disminución del nivel de conciencia se les administrará oxigeno suplementario, naloxona, glucosa y tiamina intravenosa. La hipotensión se revertirá inicialmente mediante la reposición de volumen con suero salino, y si con esto no se consigue alcanzar unas cifras normales, los fármacos de elección son la noradrenalina y dopamina. En los pacientes inestables, la monitorización de la presión venosa central o la presión arterial pulmonar puede ser útil. La taquicardia sinusal y supraventricular generalmente no necesitan tratamiento a no ser que se asocien a hipotensión. La taquicardia ventricular se tratará con lidocaina, fenitoina o desfibrilación eléctrica, dependiendo de la estabilidad hemodinámica. Se puede administrar bicarbonato sódico ( 1 mEq/Kg ) si el QRS esta ancho. Se deben evitar los antiarrítmicos de tipo IA y II ( por ejemplo beta-bloqueantes ). Las torsades
- 7. de pointes pueden responder a la administración de sulfato magnésico ( 50 a 100 mg/Kg IV en 1 hora ) o aumentando la frecuencia cardiaca. Las bradiarritmias asociadas a compromiso hemodinámico pueden ser tratadas con atropina o isoproterenol, y el bloqueo cardiaco completo con la colocación de un marcapaso transitorio. Las convulsiones se tratarán con dosis progresivas de benzodiacepinas, seguidas de una dosis de carga de fenitoína (18 mg/Kg IV a una frecuencia maxima de 50 mg/mn). En ocasiones, puede ser necesario añadir al tratamiento un barbitúrico de acción corta (amobarbital, de 10 a 15 mg/kg IV a una dosis máxima de 100 mg/mn) o de acción larga ( fenobarbital, 20 mg/Kg IV a una dosis máxima de 30 mg/mn ). En los casos de convulsiones refractarias al tratamiento, como puede ocurrir en las intoxicaciones por loxapina, puede ser necesaria la utilización de un relajante muscular no despolarizante como el pancuronio o el vecuronio, para evitar complicaciones como hipertemia y rabdomiolisis. La diuresis forzada y la alcalinización de la orina puede ser útil para prevenir el fallo renal en pacientes con rabdomiolisis. Después de la estabilización, es importante la descontaminación gástrica, mediante los metodos habituales de lavado gástrico y carbón activado. Debido al riesgo de aspiración en pacientes que pueden sufrir disminución del nivel de conciencia, convulsiones o reacciones distónicas agudas y que las fenotiacinas son potentes antieméticos, el jarabe de ipecacuana esta contraindicado. Debido a la disminución de la motilidad gastrointestinal secundario a la intoxicación, la descontaminación gástrica puede ser útil incluso varias horas despues de la ingestión. Con respecto a las medidas de depuración extrarenal, la diálisis y la hemoperfusión no se han mostrado efectivas. Las alteraciones del sistema extrapiramidal se tratarán con difenhidramina IV a dosis de 2 mg/Kg hasta un máximo de 50 mg. Este tratamiento deberá mantenerse durante 24-72 horas para evitar las recaidas. Tambien se puede utilizar el mesilato de benzotropina a dosis de 10 mg IV. Antidepresivos Cíclicos y Nuevos Antidepresivos. Los antidepresivos cíclicos constituyen, tras las benzodiacepinas, la segunda causa más frecuente de intoxicación medicamentosa en nuestro medio, y la que con mayor frecuencia requiere ingreso en una Unidad de Cuidados Intensivos. A pesar de la reciente introducción de los antidepresivos no tricíclicos (trazodone,fluoxetina etc), los antidepresivos tricíclicos siguen siendo los medicamentos más prescritos para el tratamiento de la depresión. Las causas que contribuyen a este gran número de intoxicaciones son: 1- La amplia disponibilidad de estos medicamentos por pacientes depresivos con un alto riesgo de suicidio. 2-La gravedad de los efectos cardiovasculares y del sistema nervioso central asociado con este tipo de intoxicación. 3- La limitada eficacia de los tratamientos disponibles. Clasificacion Los antidepresivos tricíclicos pueden ser clasificados en aminas terciarias y secundarias. Las aminas terciarias son desmetiladas in vivo a su correspondiente amina secundaria, y varios de estos metabolitos (desipramina, nortriptilina ) también están disponibles para uso clínico. A dosis terapéutica, los antidepresivos cíclicos se distinguen unos de otros por su capacidad para inhibir la recaptación de neurotransmisores (norepinefrina, dopamina, serotonina), sus efectos anticolinérgicos y antihistamínicos, así como, sus efectos sedantes. Por el contrario, a dosis tóxicas
- 8. estas diferencias no son importantes, y la toxicidad de la mayoría de ellos son cualitativa y cuantitativamente similar, por lo que desde el punto de vista toxicológico pueden ser descritos conjuntamente. Los antidepresivos tricíclicos clásicos estan constituidos por un anillo central con siete elementos y un nitrógeno terminal que contiene tres elementos (aminas terciarias) o dos elementos (aminas secundarias). Las aminas terciarias incluyen amitriptilina, imipramina, doxepina, trimipramina y clomipramina. Las aminas secundarias incluyen desipramina, protriptilina y nortriptilina. Incluído con los antidepresivos cíclicos hay dos compuestos derivados de la dibenzoacepina que son la loxapina y su metabolito desmetilado amoxapina. La mianserina sería junto con la maprotilina un antidepresivo tetracíclico y como compuestos bicíclicos se encontrarían la viloxazina y zimeldina. También incluídos dentro de los antidepresivos estarían los llamados inhibidores selectivos de la recaptación de serotonina ( ISRS ) y dentro de éstos incluiríamos fluoxetina, paroxetina, sertralina, venlafaxina, fluvoxamina, zimeldina, citalopram, tianeptina y ritanserina. Farmacologia yFarmacocinetica Los efectos terapéuticos de los antidepresivos cíclicos son muy similares, pero su farmacología difiere considerablemente. A dosis terapéutica, actúan bloqueando los receptores post-sinapticos de diferentes neurotransmisores como la histamina, dopamina, acetilcolina, serotonina y norepinefrina, así como, inhibiendo la recaptación de estos neurotransmisores. También tienen efecto estabilizante inespecífico de las membranas celulares, y es a través de este mecanismo como se explica el efecto inotropo negativo o la producción de bloqueo auriculoventricular. Los efectos sobre el sistema nervioso central, estan relacionados tanto por sus acciones sobre los neurotransmisores así como su efecto directo sobre las membranas celulares. Con respecto a los fármacos ISRS, desde que en la fisiopatología de la depresión se ha implicado al sistema serotoninérgico, se han sintetizado una serie de agentes que afectan predominantemente a estos neurotransmisores (actualmente, se han identificado al menos 9 receptores de la 5-hidroxitriptamina ). La concentración sérica pico de los antidepresivos cíclicos se produce de dos a ocho horas después de la administración de una dosis terapéutica. En caso de sobredosis, y debido al efecto anticolinérgico de estas sustancias se produce un enlentecimiento del vaciado gástrico y, por lo tanto, un retraso en la absorción del fármaco. Sin embargo, en la mayoría de los casos de intoxicación, el cuadro clínico aparece rápidamente y la mayoría de las muertes se produce en las primeras horas de presentación. Los antidepresivos cíclicos tienen un volumen de distribución grande ( 10 a 20 L/Kg ), y en algunos tejidos la concentración del fármaco es de 10 a 100 veces la concentración de la sangre. La distribución de estos fármacos a los tejidos es rápida, y menos de un 1 a un 2% de la dosis ingerida esta presente en la sangre en las primeras horas tras la intoxicación. La vida media para las dosis terapéuticas es de 8 a 30 horas, siendo algo mayor en los pacientes ancianos. En caso de intoxicación, la vida media es algo más prolongada debido a que su metabolismo es saturable, pero generalmente se encuentra dentro de los valores descritos para las dosis terapéuticas. Los ADCs son metabolizados casi por completo a nivel hepático; la excreción renal de estos fármacos, los cuales son bases débiles, es insignificante aún cuando se acidifique la orina. Los ADCs son en primer lugar desmetilados, y sus metabolitos hidroxilados tienen cualitativa y cuantitativamente igual toxicidad que sus compuestos de origen. Después de una sobredosis, durante las primeras horas, la concentración de metabolitos activos es baja, pero estos metabolitos pueden aumentar la toxicidad pasadas las primeras 12 a 24 horas. Posteriormente, estos metabolitos activos sufren un
- 9. proceso de desmetilación o conjugación transformándose en compuestos inactivos que son excretados por la orina. Una pequeña cantidad tanto de compuestos originales como de metabolitos activos son excretados con la bilis. Los ADCs se unen de forma importante a las proteinas séricas, fundamentalmente a la alfa-1 glicoproteina ácida. Cambios en la concentración plasmática de esta proteína o del pH puede alterar la fracción de ADCs unido a estas proteínas, pero esto no afecta a su toxicidad en caso de intoxicación. Mecanismo de toxicidad de los antidepresivos ciclicos Los efectos tóxicos más importantes son hipotensión, arritmias, coma, convulsiones, e hipertermia. La cardiotoxicidad se debe al efecto sobre el potencial de acción de la célula cardiaca, al efecto directo sobre el tono vascular y a un efecto indirecto mediado por el sistema nervioso autonómico. La hipertermia se debe al aumento de la actividad muscular y del tono anticolinérgico. La afectación del sistema nervioso central no se conoce bien, pero parece que se debe a los efectos anticolinérgicos y antihistamínicos. Efecto sobre el potencial de acción de la celula cardiaca. El efecto electrofisiológico más importante es la inhibición de los canales rápidos de sodio, produciendo un enlentecimiento de la fase 0 de despolarización de las fibras de His-Purkinje y del miocardio ventricular, al igual que los antiarrítmicos de clase I (quinidina, procainamida, encainida, flecainida). En el electrocardiograma, esto se traduce por una prolongación del intervalo QRS, lo cual es característico de la sobredosis por ADCs. El enlentecimiento desigual de la conducción daría lugar a un bloqueo unidireccional favoreciendo el desarrollo de reentradas, que es uno de los mecanismos de producción de las arritmias ventriculares. Este tipo de arritmias se produce de igual forma, en las intoxicaciones por otras sustancias que también enlentecen la despolarización ventricular, como los antiarritmicos de clase I. El movimiento intracelular de sodio durante la fase 0 del potencial de acción, esta estrechamente acoplado con la liberación del calcio intracelular almacenado. Por lo tanto, la alteración de la entrada de sodio dentro de la célula miocardica puede alterar la contractilidad celular dando lugar a hipotensión. La inhibición de los canales de sodio es sensible in vitro al pH. El incremento del pH disminuye el enlentecimiento de la fase 0 del potencial de acción inducido por los ADCs. El aumento del pH en diversos modelos animales tiene un efecto beneficioso, mejorando el retraso de la conducción, la hipotensión y las arritmias ventriculares. Por el contrario, la acidosis puede aumentar la cardiotoxicidad inducida por estas sustancias. El incremento del pH sanguíneo, junto con el aumento de la concentración sérica de sodio, explicaría el efecto beneficioso de la administración de bicarbonato sodico en la intoxicación por ADCs. Otros efectos de los ADCs sobre el potencial de acción de las células cardiacas incluye un enlentecimiento de la fase 4 de la despolarización y de la repolarización, así como una inhibición de los canales de calcio. La prolongación de la repolarización, así como del intervalo QT, es característica tanto de las dosis terapéuticas como de la intoxicación por ADCs, predisponiendo la prolongación del QT al desarrollo de torsades de pointes, las cuales han sido descritas incluso a dosis terapéutica. Recaptación de los neurotransmisores A nivel neuronal estas sustancias producen una inhibición de la recaptación y un aumento de los niveles de determinados neurotransmisores ( norepinefrina, dopamina, serotonina ). Bloqueo colinérgico
- 10. El efecto anticolinérgico de los ADCs contribuye al desarrollo de taquicardia sinusal, hipertermia, ileo, retención urinaria, dilatación pupilar y probablemente coma. De éstos, el efecto más importante es la hipertermia, la cual se produce por una alteración de la sudoración que se observa más a menudo en pacientes con una producción excesiva de calor debido a convulsiones repetidas, mioclonias o agitación. Diversos estudios in vitro han sugerido que la capacidad de los ADCs para inducir convulsiones se encuentra relacionada con la inhibición de los receptores- GABA. Bloqueo alfa A dosis terapéuticas los ADCs producen un bloqueo alfa que da lugar a vasodilatacion e hipotensión ortostática, a dosis tóxica, la vasodilatación arterial y venosa contribuye a la hipotensión. Cuadro clínico El comienzo de los síntomas en caso de intoxicación por ADCs ocurre de forma precoz. La mayoría de los signos y síntomas se producen dentro de las primeras 6 horas tras la ingestión. El cuadro puede progresar de forma brusca e impredicible, pasando el paciente de estar despierto y alerta, a tener, hipotensión, arritmias y convulsiones en menos de una hora. Alteraciones cardiovasculares Alteraciones del intervalo QRS. La prolongación del intervalo QRS es una de las alteraciones más características de la intoxicación grave por ADCs. La morfología del complejo QRS muestra un retraso inespecifico de la conducción intraventricular; el bloqueo de rama derecha es menos frecuente. Es típica la aparición de un complejo QRS terminal de 40 msg con una desviación del eje a la derecha en el plano frontal entre 130 a 270 grados, mostrando un ensanchamiento de la onda S en las derivaciones I y aVL y de la onda R en la derivación aVR. Los pacientes con un intervalo QRS prolongado tienen mayor probabilidad de presentar complicaciones graves. Así, aquellos con un intervalo QRS de más de 0.16 segundos tienen mayor riesgo de desarrollar arritmias ventriculares, y los que tienen un QRS mayor de 0.10 segundos tienen más riesgo de sufrir convulsiones. Sin embargo, estas y otras complicaciones pueden producirse en pacientes con menor grado de ensanchamiento del QRS. Bloqueo auriculo-ventricular En la sobredosis por ADCs se produce una prolongación del intervalo PR, siendo raro la aparición de bloqueo auriculo- ventriculares de segundo y tercer grado. Intervalo QT El intervalo QT esta ligeramente prolongado a las dosis terapéuticas de los ADCs, siendo más prolongado en los casos de intoxicación. Sin embargo, el grado de prolongación del intervalo QT no tiene valor para predecir la aparición de posibles complicaciones. Taquicardia sinusal La alteración del ritmo cardíaco más frecuentemente asociada a la intoxicación por ADCs es la taquicardia sinusal, la cual esta presente en más del 50% de los pacientes. La taquicardia sinusal puede estar agravada por la hipoxia, hipotensión, hipertermia o el uso de agonistas beta-1-adrenergicos. Arritmias ventriculares La taquicardia ventricular es probablemente la arritmia ventricular más frecuente en pacientes con intoxicación por ADCs. Sin embargo, puede ser difícil de distinguir de una taquicardia sinusal con complejo QRS ancho cuando las ondas P no son visibles. La taquicardia ventricular se produce en pacientes con una marcada prolongación del
- 11. complejo QRS e hipotensión y puede ser precipitada por la aparición de convulsiones. Otros factores precipitantes pueden ser la hipoxia, hipotermia, acidosis y el uso de agonistas beta-1-adrenérgicos. La mortalidad en los pacientes con taquicardia ventricular es alta. La fibrilación ventricular generalmente es una arritmia terminal que se produce como complicación de la taquicardia ventricular y la hipotensión. Las torsades de pointes también se han descrito en las intoxicaciones por ADCs, pero es poco frecuente y puede producirse a las dosis terapéuticas de algunos ADCs. Los ritmos ventriculares lentos pueden producirse en caso de intoxicación masiva por ADCs. Arritmias tardías La toxicidad de los ADCs generalmente desaparece una vez han transcurrido las primeras 24-48 horas, teniendo su mayor toxicidad dentro de las primeras 24 horas. Sin embargo, se han descrito una serie de casos de arritmias o de muerte súbita que se producen de 2 a 5 días después de la ingestión. Sin embargo, la farmacocinetica de los ADCs no ofrece una base teórica para la aparición de toxicidad tardía y si estas arritmias tardías pueden aparecer, su incidencia es muy baja. Hipotensión La hipotensión en los pacientes intoxicados por ADCs se produce por una disminución de la contractilidad miocárdica y vasodilatación. La aparición de hipotensión no se correlaciona con la duración del complejo QRS. Otros factores que pueden contribuir a la hipotensión serían los ritmos cardíacos muy rápidos o muy lentos, la deplección de volumen intravascular, la hipoxia, la hipertermia, la acidosis, las convulsiones y la ingestión conjunta de otras sustancias cardiodepresoras o vasodilatadores. Alteraciones del sistema nervioso central Coma La depresión del nivel de conciencia se produce por lo general, en pacientes con un complejo QRS prolongado. El coma puede de todas formas ocurrir con un intervalo QRS de una duración dentro de los valores normales, cuando se asocia a la ingestión de otras sustancias depresoras del sistema nervioso central. Delirio El delirio puede aparecer tras la ingestión de dosis bajas de ADCs ó bien de forma precoz tras una ingesta importante de estas sustancias. Se caracteriza por agitación, desorientación o conducta psicótica. El mecanismo parece que es debido al bloqueo colinérgico a nivel del sistema nervioso central, por lo que puede acompañarse de otros signos anticolinérgicos tales como hipertermia, sequedad de piel, midriasis, taquicardia sinusal, ileo y retención urinaria. Convulsiones y mioclonias Las convulsiones son más frecuentes en pacientes con QRS prolongado. La maprotilina y la amoxapina son los ADCs que con mayor frecuencia producen convulsiones, aunque en otro estudio retrospectivo también se describe una incidencia alta de convulsiones con la desipramina. Las convulsiones se producen con mayor frecuencia en las primeras horas tras la ingestión y suelen ser generalizadas, breves y remitir antes de que se pueda administrar algún anticonvulsivante. Las convulsiones producen acidosis, hipertermia o rabdomiolisis; siendo generalmente bien toleradas. En la serie de Ellison y colaboradores, 4 de 30 pacientes con convulsiones debidas a intoxicación por ADCs, desarrollaron un marcado deterioro cardiovascular con hipotensión y arritmias ventriculares durante las convulsiones o posterior al cese de éstas.
- 12. Las mioclonias son menos frecuentes que las convulsiones, y aunque las complicaciones son las mismas, estas son menos probables que ocurran. Hipertermia La hipertermia en la intoxicación por ADCs es debida a la producción excesiva de calor ( convulsiones, mioclonias o agitación ) junto con una alteración de los mecanismos de disipación de ese calor ( disminución de la sudoración ). La muerte o las secuelas neurológicas se producen en los pacientes intoxicados cuando la temperatura corporal supera los 41ºC durante varias horas. La morbilidad y mortalidad asociada a la hipertermia inducida por la intoxicación por ADCs puede estar favorecida por la coexistencia de otras agresiones al sistema nervioso central como la hipoxia y la hipotensión. Otras alteraciones La retención urinaria y el ileo intestinal son frecuentes en la intoxicación por ADCs. El tamaño pupilar es variable, debido a la doble influencia del bloqueo colinérgico y de los receptores alfa. Las pupilas no reactivas a la luz han sido descritas en raras ocasiones. Las complicaciones pulmonares incluyen la neumonitis por aspiración y el síndrome de distress respiratorio del adulto. Estas complicaciones son generalmente secundarias al coma, a la infección pulmonar o al excesivo aporte de líquidos más que a un efecto primario de los ADCs. Diagnostico diferencial Otras muchas sustancias producen algunos de los efectos de los ADCs. Así, los fármacos anticolinérgicos y antihistamínicos producen los mismos efectos a nivel periférico, como midriasis pupilar, disminución del peristaltismo intestinal, confusión y convulsiones. De todos modos, las intoxicaciones que con mayor frecuencia pueden confundirse con la sobredosis de ADCs son aquellas que dan lugar a un ensanchamiento del complejo QRS. Asi, la tioridazina y mesoridazina, dos fenotiacinas, prolongan el complejo QRS y el intervalo Q-Tc. Otras causas que producen un ensanchamiento del complejo QRS serían la hiperpotasemia y la hipocalcemia. Esta última, además, daría lugar a la aparición de espasmos musculares y mioclonias. Los beta-bloqueantes, principalmente el propanolol pueden causar convulsiones y trastornos de la conducción cardíaca. El Tramadol, un nuevo analgésico opiaceo que produce una inhibición de la recaptación de las aminas biológicas, puede teóricamente dar lugar a los efectos de la intoxicación por opiaceos y ADCs. La carbamacepina puede producir los mismos efectos tóxicos que los ADCs, incluso puede producir o agravar un bloqueo auriculoventricular, pero no prolonga la duración del complejo QRS. La cardiotoxicidad de los ADCS puede ser difícil de diferenciar de la producida por la sobredosis de antiarrítmicos de clase Ia (quinidina, procainamida y disopiramida) y clase Ic (flecainida, encainida y propafenona). Tratamiento Los pacientes intoxicados por antidepresivos cíclicos precisan una evaluación y estabilización inmediata. En los pacientes despiertos y conscientes se administrará una dosis de carbón activado. En el caso de que el paciente haya tomado antidepresivos cíclicos clásicos ( amitriptilina, nortriptilina, imipramina, desipramina, clomipramina, doxepina, protriptilina y maprotilina ) puede ser observado en la sala de urgencias si está asintomático; es decir, si tiene un electrocardiograma normal durante el período de observación, taquicardia sinusal que se resuelve en las dos primeras horas y un nivel de conciencia normal. El período de observación debe abarcar unas 6 horas, y durante este periodo el paciente debe tener monitorizado el ritmo cardiaco y canalizada una vía venosa. No hay consenso sobre la posibilidad de observación en la sala de urgencias de los pacientes que han tomado bupropion, trazodone o ISRS ( fluoxetina, paroxetina y
- 13. sertraline ) debido a la escasez de datos que hay sobre la intoxicación por estas sustancias. Antes del alta hospitalaria estos pacientes deben ser evaluados por un psiquiatra. En los pacientes sintomáticos, hay que hacer una rápida evaluación, y si hay disminución del nivel de conciencia o hipoventilación, se debe aislar la vía aérea y ventilar al paciente para evitar la acidosis respiratoria, ya que ésta podría empeorar el cuadro. La descontaminación gástrica se realizará, mediante lavado gástrico, estando contraindicado el jarabe de ipecacuana debido a la rapidez con que estos pacientes pueden presentar convulsiones y coma. Posteriormente, se administraran de 50 a 100 gr de carbón activado ( aproximadamente 1 gr/kg de peso ); a la vez que administramos un catártico. Si hay disminución del nivel de conciencia, administraremos de 25-50 gr de glucosa ( 0.5 a 1 gr/kg ), 2 mg de naloxona y 100 mg de tiamina, todo por vía intravenosa. Debido a que algunos antidepresivos tienen circulación enterohepática, además administraremos dosis sucesivas de carbón activado, cada 4 horas hasta que el paciente despierte. Esto no se administrara en presencia de ileo o distensión gástrica. La hemodiálisis es ineficaz para aumentar la eliminación de los ADCs debido a la unión de estos con las proteínas plasmáticas y su liposolubilidad. La hemoperfusión no tiene estas limitaciones, pero sigue siendo ineficaz para reducir los efectos tóxicos de los ADCs debido a su gran volumen de distribución. Las convulsiones suelen ser breves y simples, y se trataran con benzodiacepinas. Como frecuentemente son aisladas no es necesaria la utilización de anticonvulsivantes. Sin embargo, en el estatus epiléptico ( muy frecuente con la amoxapina ) hay que ser más agresivo para prevenir el desarrollo de acidosis, hipertermia y rabdomiolisis, por lo que utilizaremos dosis altas de benzodiacepinas ( 30 a 50 mg de diacepan ). Si con esto no se controlan, algunos autores recomiendan la utilización de un relajante muscular no despolarizante de acción corta, como el vecuronio, a la vez que se administra un fármaco anticonvulsivante. La duración de la acción del vecuronio, es aproximadamente igual al tiempo que tarda en hacer efecto una dosis IV de carga de fenobarbital (15-20 mg/kg), thiopental (3-5 mg/kg ) o fenitoína (18 mg/kg). Si disponemos de monitorización electroencefalográfica continua y persisten las convulsiones, una vez ha desaparecido el efecto de los relajantes musculares, se deben administrar dosis adicionales de vecuronio, con un fármaco anticonvulsionante alternativo o anestesia general. La alcalinización mejora las alteraciones de la conducción cardíaca pero no tiene efectos sobre las convulsiones. La hipotensión es otra complicación frecuente de la intoxicación por ADCs. Inicialmente, se tratará con reposición de volumen. Debido a que la mayoría de los intoxicados tienen acidosis o alteraciones del ritmo cardíaco e hipotensión, podemos utilizar una solución de bicarbonato, con la cual, al mismo tiempo alcalinizaríamos el suero y repondríamos los líquidos. Para ello utilizaremos 1000 ml de una solución de glucosa al 5% a la que se le añaden de 100 a 150 mEq de NaHCO3. Si la función renal es normal y el potasio sérico no esta elevado añadiremos de 20 a 40 mEq de ClK. La dosis de administración se ajustara para mantener un pH aproximado de 7.45 a 7.55. En un paciente adulto, una dosis inicial de aproximadamente 200 a 300 ml hora, puede ser adecuada para conseguir estos objetivos. En caso de afectación cardíaca, puede ser necesaria una monitorización invasiva ( línea arterial, presión venosa central, cateterización de arteria pulmonar ). Si se precisa tratamiento con agentes vasopresores, los agentes simpaticomiméticos directos como la norepinefrina son más
- 14. efectivos que los agentes indirectos como la dopamina. Si la hipotensión es refractaria, igual es necesario añadir un agente inotrópico como dobutamina. En cuanto a las alteraciones de la conducción ( complejo QRS mayor de 100 msg en las derivaciones de los miembros ) y las arritmias ventriculares, el tratamiento de elección es la alcalinización. La administración de una solución de bicarbonato sodico combinado con hiperventilación, es más útil que cada uno de estos tratamientos por separado. La hiperventilación sola puede ser efectiva si el paciente no tolera la sobrecarga de sodio. Combinando ambos tratamientos, la PCO2 se mantiene alrededor de los 30 mm Hg, con lo cual se previene la vasoconstricción cerebral, y la concentración de sodio se mantiene dentro de los valores normales. Si las arritmias ventriculares no responden a la alcalinización, pueden hacerlo a la lidocaína. Aparte de los beta-bloqueantes, no se han estudiado otros antiarrítmicos en el tratamiento de las arritmias ventriculares producidas por la intoxicación por ADCs. En diferentes modelos animales, el propanolol fue efectivo mejorando la conducción, pero puede dar lugar a cuadros de hipotensión refractaria. La capacidad de la fenitoína para corregir las anomalías de la conducción cardíaca es anecdótica y no hay ningún estudio objetivo que lo demuestre. Los antiarrítmicos de la clase IA y Ic están contraindicados por su cardiotoxicidad aditiva. El uso del bretilio en estos casos no ha sido estudiado. El sulfato de magnesio es potencialmente útil, pero fue ineficaz en diversos estudios con modelos de animales.La implantación de un marcapaso ventricular transitorio puede ser útil en los casos de bloqueo auriculo-ventricular completo. En los pacientes con riesgos de hipertermia ( aquellos con agitación, mioclonias y convulsiones ) la temperatura corporal se debe medir cada 30 mn. Una temperatura corporal de más de 41ºC puede producir un daño neurológico definitivo. Las medidas de enfriamiento deben de instaurarse antes de que se alcance dicha temperatura. Las medidas estándares de enfriamiento, incluirían, la aplicación externa de hielo o el lavado gástrico con agua helada. Pronostico Una vez superadas las primeras 24 horas, sin que aparezcan ninguna de las complicaciones principales ( hipoxia, convulsiones prolongadas, acidosis profunda, hipertermia y alteraciones del complejo QRS ) la evolución suele ser favorable. Si las alteraciones de la conducción cardíaca mejoran (estrechamiento del complejo QRs por debajo de los 100 msg), la alcalinización se puede suspender ( generalmente dentro de las primeras 12 horas ) y permitir que el pH se normalice. Si el complejo QRS se ensancha de nuevo, debemos reanudar la alcalinización y comenzar el proceso de nuevo. Una vez que el electrocardiograma se ha normalizado, sin alcalinización, el paciente debe ser monitorizado durante unas 12 a 24 horas más en la UCI. El paciente debe estar despierto y consciente, asi como haber pasado carbon a las heces antes de ser dado de alta de la unidad. Todos los pacientes deben ser valorados por el psiquiatra antes de ser dados de alta. Otros tratamientos Actualmente, hay dos modalidades de tratamiento en las intoxicaciones por ADCs que están siendo evaluadas. Por un lado, en pacientes muy graves en los que el tratamiento habitual ha fracasado, la utilización de diversos sistemas mecánicos de soporte circulatorio, como el balón de contrapulsación intraaórtico o el bypass cardíaco. En estos casos, es conveniente la utilización de medidas de apoyo extracorpóreas que permitan mantener la perfusión miocárdica, hepática y cerebral, mientras se produce el aclaramiento hepático endogeno de los ADCs. Así, se ha descrito un caso de un niño que sobrevivió a 2.5 horas de masaje cardiaco externo durante una taquicardia ventricular sin pulso, debido a una intoxicación por imipramina.
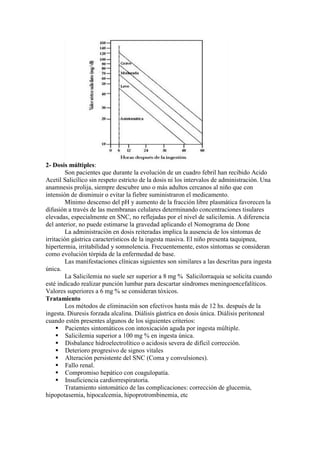
- 15. El otro tipo de tratamiento, sería la utilización de la inmunoterapia para el tratamiento de estas intoxicaciones. Asi, se han desarrollado anticuerpos frente al fragmento Fab de los ADCs. La utilización de estos fragmentos Fab en el tratamiento de la intoxicación por desipramina en un modelo animal ha mejorado la tensión arterial y ha disminuido el ensanchamiento del complejo QRS. Finalmente, la combinación de bicarbonato sódico hipertónico y fragmentos Fab de desipramina produce una mejoría mayor de los parámetros hemodinámicos que, con la utilización sóla de los fragmentos Fab. Acido Acetil Salicílico Agente analgésico, antitérmico y antiinflamatorio de amplia difusión. Las consultas se originan en ingestiones accidentales o por administración incorrecta con fines terapéuticos. Es importante tener en cuenta que está presente en algunas pomadas, linimentos y en medicaciones caseras. Se absorbe en estómago y duodeno y más lentamente a nivel rectal. También por la piel intacta, especialmente el metilsalicilato. Se distribuye por todos los tejidos, atravesando barrera hematoencefálica y placenta. La biodegradación es más importante a nivel del Retículo Endoplásmico y mitocondrias del hígado. Se elimina por orina. La Vida Media en sobredosis puede sobrepasar las 30 Hs. Se reconocen dos cuadros que comparten muchas de las manifestaciones clínicas, pero factores farmacocinéticos determinan diferencias de interés en relación a la evolución, pronóstico y tratamiento. 1- Sobredosis única: Por ingesta en un solo momento. En pacientes pediátricos, casi la totalidad de los casos se origina en ingesta accidenta. La dosis ingerida orienta sobre el grado de toxicidad esperada. Cuadro clínico El paciente presenta náuseas o vómitos, palidez, diaforesis, vértigo, acúfenos, taquipnea, fiebre e irritabilidad. Dependiendo de la dosis ingerida el cuadro progresa a la acidosis metabólica, deshidratación, oliguria, coma y convulsiones. Inicialmente puede detectarse hiperglucemia por déficit tisular de utilización de glucosa pero más tarde se instala hipoglucemia por agotamiento de los depósitos de glucógeno. Especialmente en las ingestas reiteradas desde el principio se detecta hipoprotrombinemia, secundaria a la inhibición de la síntesis del factor VIII. Otros parámetros de laboratorio constantes son la disminución de K+ y Ca++ y en relación al grado de compromiso renal aumento de creatinina y urea. Manifestaciones menos frecuentes incluyen edema pulmonar, necrosis tubular aguda, broncoespasmo, síndrome de secreción de antidiurética, hemólisis, anormalidades ECG y rabdomiolisis. La salicilemia superior a 40 mg %, confirma el diagnóstico. La saliciluria tiene valor orientador. Conociendo la hora de exposición, la gravedad del proceso se puede estimar a través del Nomograma de Done. El mismo relaciona la concentración del salicilato en sangre (salicilemia) y el tiempo transcurrido desde la ingesta.
- 16. 2- Dosis múltiples: Son pacientes que durante la evolución de un cuadro febril han recibido Acido Acetil Salicílico sin respeto estricto de la dosis ni los intervalos de administración. Una anamnesis prolija, siempre descubre uno o más adultos cercanos al niño que con intensión de disminuir o evitar la fiebre suministraron el medicamento. Mínimo descenso del pH y aumento de la fracción libre plasmática favorecen la difusión a través de las membranas celulares determinando concentraciones tisulares elevadas, especialmente en SNC, no reflejadas por el nivel de salicilemia. A diferencia del anterior, no puede estimarse la gravedad aplicando el Nomograma de Done La administración en dosis reiteradas implica la ausencia de los síntomas de irritación gástrica característicos de la ingesta masiva. El niño presenta taquipnea, hipertermia, irritabilidad y somnolencia. Frecuentemente, estos síntomas se consideran como evolución tórpida de la enfermedad de base. Las manifestaciones clínicas siguientes son similares a las descritas para ingesta única. La Salicilemia no suele ser superior a 8 mg % Salicilorraquia se solicita cuando esté indicado realizar punción lumbar para descartar síndromes meningoencefalíticos. Valores superiores a 6 mg % se consideran tóxicos. Tratamiento Los métodos de eliminación son efectivos hasta más de 12 hs. después de la ingesta. Diuresis forzada alcalina. Diálisis gástrica en dosis única. Diálisis peritoneal cuando estén presentes algunos de los siguientes criterios: Pacientes sintomáticos con intoxicación aguda por ingesta múltiple. Salicilemia superior a 100 mg % en ingesta única. Disbalance hidroelectrolítico o acidosis severa de difícil corrección. Deterioro progresivo de signos vitales Alteración persistente del SNC (Coma y convulsiones). Fallo renal. Compromiso hepático con coagulopatía. Insuficiencia cardiorrespiratoria. Tratamiento sintomático de las complicaciones: corrección de glucemia, hipopotasemia, hipocalcemia, hipoprotrombinemia, etc
- 17. Paracetamol Acetaminofen o N-acetil-p-aminofenol. Tiene rápida absorción oral y el pico de concentración se produce en 20-90 min. Se metaboliza a nivel hepático. A dosis terapéuticas un 90% se conjuga con sulfatos y ácido glucurónico, 8% por N- Hidroxilación da lugar a un metabolito reactivo: N-acetil-Benzoquinoneimina este metabolito responsable de la toxicidad, en condiciones normales es inactivado por el glutatión reducido. En las sobredosis (Dosis Tóxica:140 mg/Kg), el glutatión se agota rápidamente y la N-acetil-Benzoquinoneimina se une a las proteínas hepáticas produciendo necrosis. Cuadro clínico Evoluciona en 4 etapas Fase I: Náuseas – Vómitos – Diaforesis – Laboratorio Normal Fase II: Remisión de los síntomas – Transaminasas y Bilirrubina ligeramente elevadas – Tiempo de Protrombina prolongado. Fase III: Insuficiencia hepática - Transaminasas y Bilirrubina muy elevadas – hipoglucemia – Alteración de la coagulación – coma – fallo renal. Fase IV: Resolución Puede cursar con: Miocardiopatía – Anemia hemolítica – Metahemoglobinemia – Pancreatitis Tratamiento Métodos de eliminación. Descartar el uso de Carbón Activado para evitar la neutralización del antídoto. Los pacientes con ingesta superior a 140 mg/Kg recibirán tratamiento específico con N-Acetilcisteína: Dosis de ataque 140 mg/Kg por vía oral, continuando con 70 mg/Kg cada 4 hs.durante 3 días. Intoxicación por gotas nasales El abuso de este tipo de medicamentos tanto en adultos como en niños, es muy frecuente debido a la supuesta no toxicidad del producto. Imidazólicos, que también pueden estar presentes en algunas gotas oftálmicas. Los derivados Imidazólicos como la Nafazolina, la Oximetazolina, la Xilometazolina, etc. poseen acciones simpaticomiméticas y parasimpaticomiméticas que generan un cuadro agudo de intoxicación. Esto sucede cuando el niño se introduce el frasco gotero en la boca, ingiriendo accidentalmente su contenido, o mientras se colocan las gotas nasales, sale un chorro en forma súbita. Cuando esto sucede estamos ante un cuadro potencialmente grave. Sepa que con pocas gotas puede existir un efecto de idiosincrasia (susceptibilidad peculiar o personal a un fármaco) El intoxicado presentará los siguientes síntomas: • Sobre la mucosa nasal ocasiona irritación y obstrucción, efectos indeseables que aparecen luego del período descongestivo. • Hay hipertensión por vasoconstricción periférica, seguido luego de hipotensión por efecto rebote. • Los niños presentan las pupilas dilatadas (midriasis), pulso lento (bradicardia), palidez, sudoración, con hipoglucemia marcada e hipotermia franca, la respiración es irregular, pudiendo existir depresión respiratoria. • Al nivel de sistema nervioso central existe cefalea y alteración del sensorio que va de la somnolencia al coma.
- 18. “Con el uso en forma prolongada de este fármaco existe riesgo de adicción” "La triada palidez, hipotermia y bradicardia deben hacer pensar en intoxicación por Nafazolina, Xilometazolina u Oximetazolina". Sales de Hierro El hierro es el oligoelemento más abundante, conteniendo el adulto unos 4-5 g, distribuidos entre: Hierro de reserva (1-1,5 g) depositado en forma de ferritina y hemosiderina en hígado, bazo y médula ósea. Hierro funcional, en forma de hemoglobina (3 g) y otras heminas y enzimas celulares (0,5 g). Hierro circulante, unido a la transferrina (3 mg). El metabolismo del hierro es cerrado, no se pierde al exterior y sólo una pequeña cantidad son pérdidas obligadas (0,5-1,5 mg/día): descamación celular (0,5 mg) y en la mujer con la menstruación (15-20 mg/mes). La homeostasia del hierro se regula mediante la adaptación de la absorción a las necesidades. La dieta normal contiene 10-15 mg de hierro, con absorción en el duodeno y primera porción del yeyuno del 10-15%, pudiendo aumentar hasta un 80% en casos de déficit. Las necesidades de hierro del organismo varían según edad, sexo y estado fisiológico del individuo (infancia, adolescencia, menstruación y embarazo). Es un medicamento indicado en el tratamiento de las anemias ferropénicas o en su prevención (suplementos prenatales, hipermenorreas, etc). Puesto que el contenido de hierro varía en función del tipo de sal que tenga el preparado comercial (fumarato ferroso, sulfato ferroso), en caso de intoxicación es preciso calcular la dosis ingerida en función del hierro elemento. En la tabla 1 se exponen los preparados férricos más habituales que se utilizan en la práctica médica. Epidemiología A diferencia de las intoxicaciones por otros metales, normalmente asociadas a la exposición profesional, la mayor parte de las intoxicaciones agudas por sales de hierro se observan en niños de corta edad que han ingerido grageas coloreadas de sulfato ferroso u otro preparado férrico. Es una de las intoxicaciones infantiles más prevalentes en Inglaterra y Estados Unidos que con mayor frecuencia tienen un desenlace fatal: una muerte infantil por mes. Incidencia aproximada en Estados Unidos es de 5000 casos/año. En los adultos es rara, y generalmente ocurre en personas con ideas suicidas. Mecanismos de acción La acción tóxica del hierro resulta del efecto corrosivo directo y de la toxicidad celular que posee. A. Efecto corrosivo directo sobre las mucosas, pudiendo causar necrosis hemorrágica y perforación. La pérdida de líquidos a través del tracto gastrointestinal puede ocasionar severa hipovolemia. B. La absorción férrica causa disfunción celular con acidosis láctica y necrosis. El mecanismo exacto de la toxicidad celular no se conoce. Cinética Absorción
- 19. El mecanismo íntimo de la absorción y su control no se conocen con precisión. El hierro iónico se une a receptores de las células intestinales del duodeno y primera porción del yeyuno y pasa a su interior por transporte activo. La presencia de ferritina en las células de la mucosa intestinal podría regular la cantidad de hierro que se absorbe. Del total de 15 a 18 mg de hierro que se ingieren al día con una dieta de 2500 a 3000 calorías, sólo un 5-10% es absorbido. Unión a proteínas plasmáticas El hierro (Fe+++) es transportado en la sangre por la transferrina . Cada molécula de transferrina posee dos receptores capaces de unirse, cada uno de ellos, a un ion de Fe+++. Su concentración plasmática normal es de 250-360 mg/100 ml. En el diagnóstico hematológico es útil el índice de saturación de la transferrina, que normalmente oscila entre 21 y 45%. Depósitos de hierro La mayor parte del hierro (30%) se halla en distintos depósitos: médula ósea, bazo, tejido muscular, hígado y otros. Compuestos que albergan el hierro de depósito en las células del Sistema Mononuclear Fagocítico son: • Ferritina: Cada molécula contiene entre 3000 y 5000 átomos de hierro. (Valor normal en suero: 13-150 µg/l o ng/ml). • Hemosiderina: Formada por agregados de hierro en forma micelar. Excreción Mecanismo no conocido con exactitud. En condiciones normales las pérdidas de hierro son mínimas y fáciles de compensar con la ingesta diaria. Si la absorción del hierro de la dieta se interrumpiese por completo sería necesario un período de casi tres años para que tuviera lugar la depleción de los depósitos de hierro en ese individuo y un período mucho mayor para que el sujeto desarrollara anemia. La eliminación diaria no supera los 2 mg. Dosis tóxica La DL50 en animales de experimentación es de 150-200 mg/Kg de Fe elemento. La dosis letal más baja descrita en la infancia es de 600 mg. Dosis tóxica: 20 - 60 mg/kg de Fe elemento: • 20 - 30 mg/kg : Vómitos, dolor abdominal, diarrea. • > 40 mg/Kg : Coma, discrasia sanguínea. Dosis potencialmente letal: > 60 mg/Kg. Manifestaciones clínicas Habitualmente descritas en cuatro períodos: Período inicial (½- 2h postingesta): Inmediatamente tras la ingesta, los efectos corrosivos del hierro sobre el tracto gastrointestinal causan vómitos, diarrea, frecuentemente sanguinolenta, y hematemesis. Período quiescente (hasta 12 horas): Período latente de aparente mejoría durante 12 horas. En caso de intoxicación severa este período puede ser más breve. Período recurrente (12-48 horas): Síntomas sistémicos: • Tracto gastrointestinal: Hematemesis, melenas, perforación. • Sistema Nervioso Central: Letargia, coma, convulsiones. • Cardiovascular: Shock hipovolémico, edema pulmonar, cianosis. • Hepatorrenal: Insuficiencia hepatorrenal con trastornos de la coagulación.
- 20. • Metabolismo: Acidosis metabólica severa, hipoglicemia. Período tardío (2 a 6 semanas): Estenosis pilórica, obstrucción intestinal e infarto gangrenoso del tracto gastrointestinal. Diagnóstico La sospecha de intoxicación aguda por hierro debe ser confirmada lo antes posible, ya que cuanto antes se instaure el tratamiento, menos complicaciones clínicas se observarán. Método ideal : Medición de las concentraciones séricas de hierro (valores normales hasta 150 µg/100 ml), siempre y cuando se obtenga una muestra de sangre antes de las 4 horas posteriores a la sobredosis (transcurrido este tiempo, su cuantificación no es fiable, ya que el hierro desaparece del plasma, y se fija a los tejidos). El diagnóstico se basa, por tanto, en una historia de exposición al tóxico acompañada de la presencia de síntomas y signos guía como vómitos, diarrea , letargia, hipotensión y taquicardia. El indicador más sensible de ingesta importante son los vómitos (sensibilidad del 94% y especificidad del 25%). La diarrea, sobretodo sanguinolenta, es menos sensible pero más específica como indicador de ingesta severa. Gravedad Ante la imposibilidad de determinar concentraciones de hierro o superado el tiempo de 4 horas desde la ingesta, la coexistencia de más de uno de los datos siguientes indica casi con toda seguridad que las concentraciones séricas de hierro están o han estado por encima de 300 µg/100 ml (o 54 µmol/l): a- Leucocitosis superior a 15.000 /mm3. b- Hiperglicemia superior a 150 mg/100 ml. c- Vómitos y diarrea. d- Radiografía simple de abdomen positiva (presencia de pastillas radioopacas). Suele existir buena correlación entre la analítica toxicológica y el estado clínico de los pacientes. Tratamiento A nivel extrahospitalario o durante el transporte sanitario, no se recomienda iniciar ninguna terapia específica sino atender sólo al estado de las constantes vitales y a efectuar en caso necesario un tratamiento sintomático (anticonvulsivantes, etc). Tratamiento inespecífico Medidas generales de apoyo. Tratamiento específico La inducción de la emésis (jarabe de ipecacuana) y el lavado gástrico son útiles hasta 4 horas después de la sobredosis. El lavado gástrico debe realizarse en todo paciente que haya ingerido más de 10-20 mg de hierro/Kg de peso o presente manifestaciones clínicas. Añadir 50 mEq de bicarbonato sódico 1 M por cada litro de líquido empleado para el lavado gástrico. Finalizado el lavado, dejar 100 ml de bicarbonato sódico al 5% (5 g en 100 ml de agua) -la alcalinización del estómago induce la conversión de hierro ferroso en sales no solubles de carbonato ferroso, que se absorbe con más dificultad que el hierro ferroso-. El empleo de carbón activado no está aconsejado, ya que no absorbe el hierro. Tratamiento antidótico: Desferoxamina La quelación abarca al hierro libre y al unido a transferrina. Para ser eficaz debe administrarse en las primeras 12-16 h. 100 mg de desferoxamina quelan 8,5 mg de hierro.
- 21. Presentación: Desferín®, 1 vial=500 mg/5 ml. Su administración e.v. deberá empezarse de inmediato en todos aquellos pacientes con concentraciones séricas de hierro superiores a 500 µg/100 ml o síntomas graves como letargia, coma shock o hipotensión, aunque se desconozca la sideremia. Dosis: 15 mg/Kg/hora en perfusión continua (suero fisiológico o glucosado al 5%), sin superar los 80 mg/Kg/dia. Mantener la perfusión hasta que desaparezca el color rosado de la orina que indica el cese de la eliminación del complejo hierro-desferoxamina. En casos menos graves puede emplearse la vía intramuscular: 90 mg/Kg/8 horas (máximo 1 g en niños y 2 g en adultos). Ha reducido la mortalidad hospitalaria del 50% a <2%. Reacciones adversas: • Frecuentes: Hipotensión. • Infrecuentes: Anafilaxia, trombopenia, hipoacusia, anemia hemolítica, distrés respiratorio, teratogenia. Bibliografia • Herbert, A., Ralston, J. (2001): Cutaneous Reactions to Anticonvulsant Medications. J Clin Psychiatry 62(suppl 14): 22-26. • Schatzberg, A., Nemeroff, Ch. (1998). Textbook of Psychopharmacology, 2° Edition. American Psychiatric Press,Washington, DC. • Farmacología Fundamental de Andrés Repetto. • Guía Cátedra Toxicología- Dra Ana María Girardelli