guía tabla periodica
- 1. QUÍMICA COMÚN QC-03 2015 TA B L A PE R I Ó D I C A
- 2. 2 INTRODUCCIÓN El gran número de elementos químicos descubiertos y sustancias sintetizadas en el laboratorio generó la necesidad urgente de clasificarlos. A principios de 1812 el químico alemán John W. Döbereiner intentó una primera aproximación al ordenar los elementos descubiertos en grupos de tres (tríadas). Esta clasificación implicó agruparlos en forma creciente de acuerdo con su masa atómica. En 1860 el francés Alexandre Béguyer (un geólogo francés) verificó cierta periodicidad en los elementos al comparar sus tamaños y propiedades físicas. En sus estudios verificó una secuencia lógica entre las magnitudes y propiedades observadas en los átomos y sus respectivos tamaños y abundancias. En 1864, Julius Lothar Meyer publicó la primera versión de la tabla periódica y más tarde el químico ruso Dmitri Ivanovich Mendeléiev enunció y publicó la Ley Periódica y La Tabla Periódica de los Elementos químicos. La capacidad predictiva de Mendeléiev fue brillante; no sólo enunció la ley de periodicidad química, también ordenó los elementos encontrados y guardó espacio para aquellos que aún no habían sido descubiertos, incluso predijo sus propiedades físicas y químicas. LA TABLA PERIÓDICA ACTUAL El comportamiento de los átomos está determinado por su configuración electrónica, siendo la distribución de los electrones en el nivel más externo la que determina su reactividad y naturaleza química. Por esta razón, aquellos elementos que poseen una distribución electrónica similar presentarán propiedades químicas similares. Las propiedades de los átomos se repiten periódicamente si los elementos químicos se ordenan según su número atómico creciente (Z). ANÁLISIS
- 3. 3 En la tabla periódica, los elementos que tienen un patrón similar de configuración electrónica en la capa externa se disponen en las mismas columnas (GRUPOS O FAMILIAS). Aquellos elementos que presentan idénticos niveles energéticos se disponen en las mismas filas (PERIODOS). G R U P O S 18 columnas Los elementos de un mismo grupo poseen propiedades químicas similares y se caracterizan por tener igual número de electrones en el último nivel de energía. Cada elemento de un grupo se ubica en períodos distintos y para designarlos se anota con numeración romana (I, II, III, IV, etc.) la cantidad de electrones en ese último nivel, seguido de una letra (A ó B) que identifica su naturaleza y los tipos de orbitales que presenta. Elementos Representativos: A (último electrón ubicado en orbital s ó p) Elementos de Transición: B (último electrón ubicado en orbital d ó f) P E R I O D O S 7 filas Los elementos de un mismo período presentan igual número de niveles energéticos con electrones. Los períodos se numeran considerando el valor del nivel energético más externo. Cada período comienza con un metal alcalino y concluye con un gas noble a excepción del primer nivel, donde se ubica el Hidrógeno. Definiciones relevantes: •Es el último electrón de la configuración electrónica, el más energético. Electrón diferencial •Es aquel que se encuentra semicompletando un orbital.Electrón desapareado •Son aquellos que se ubican de a par en un orbital.Electrones apareados •Son aquellos que se encuentran en el último nivel incompleto de energía. Son los electrones que participan en el enlace. Electrón de valencia •Es aquel elemento que presenta uno o más electrones desapareados en sus orbitales. Este fenómeno provoca que el átomo sea atraido por un campo magnético externo. Elemento paramagnético •Es aquel elemento que presenta sólo electrones apareados, de modo que el elemento NO es atraido por un campo magnético. Elemento diamagnético
- 4. 4 ANÁLISIS DE UNA CONFIGURACIÓN ELECTRÓNICA Determinación del grupo, período, número de electrones desapareados y número de electrones de valencia para un átomo. Ejercicio resuelto: Considere un elemento con 15 electrones en total. De acuerdo con su configuración electrónica extendida se deduce que Pertenece al grupo V-A, es un elemento nitrogenoide. El elemento es paramagnético (3 de sus 5 electrones de valencia se encuentran desapareados) Presenta 3 niveles de energía con electrones, por lo tanto se ubica en el período 3. Se trata del átomo de Fósforo, en estado basal (15P) ELEMENTOS EN EL SISTEMA PERIÓDICO
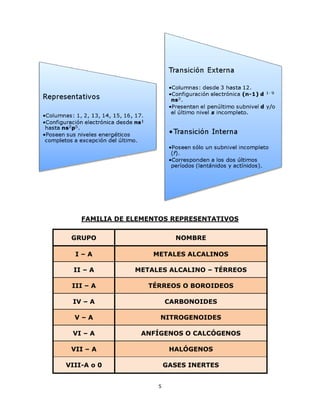
- 5. 5 FAMILIA DE ELEMENTOS REPRESENTATIVOS GRUPO NOMBRE I – A METALES ALCALINOS II – A METALES ALCALINO – TÉRREOS III – A TÉRREOS O BOROIDEOS IV – A CARBONOIDES V – A NITROGENOIDES VI – A ANFÍGENOS O CALCÓGENOS VII – A HALÓGENOS VIII-A o 0 GASES INERTES
- 6. 6 NATURALEZA DE LOS ELEMENTOS GASES NOBLES Columna 18 en la tabla periódica. Grupo VIII o 0. Se caracterizan por tener todos sus niveles electrónicos completos. Configuración electrónica del tipo ns2 p6 , ns2 (Helio). En condiciones normales son químicamente inertes (muy poco reactivos). ELEMENTOS METÁLICOS Son casi todos sólidos (a temperatura ambiente), a excepción del Mercurio, Cesio y Rubidio. Son muy buenos conductores de la corriente eléctrica. Pierden electrones con facilidad, transformándose en cationes estables. Poseen brillo metálico y son muy buenos conductores de calor. Son dúctiles, lo que permite que bajo la acción de una fuerza puedan deformarse sin romperse. Son maleables, es decir, su capacidad de deformación permite su uso para la confección de láminas. ELEMENTOS NO METÁLICOS No poseen brillo metálico. No son dúctiles ni maleables. Son malos conductores de la corriente eléctrica y calor. Corresponden íntegramente a los elementos del grupo VI–A y VII–A. Se estabilizan formando aniones estables pues tienen facilidad para captar electrones.
- 7. 7 PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS Anteriormente, vimos que la configuración electrónica de los elementos se relaciona directamente con sus características físicas. Su naturaleza está íntimamente relacionada con el valor de su número atómico, de modo que la periodicidad (relaciones en un periodo) será cambiante mientras aumente o disminuya el valor de Z en los átomos. Se ha verificado que muchas propiedades físicas y de tamaño muestran variabilidad a lo largo de un periodo siendo crecientes o decrecientes según cambie el número de electrones de valencia. Una propiedad NO será periódica si no hay correlación entre el valor de Z y la variación de alguna propiedad medida en un período. Ejemplo de éstas son la masa atómica y el calor específico. PROPIEDADES RELACIONADAS CON EL TAMAÑO EL RADIO ATÓMICO Asumiendo al átomo como una esfera perfecta, es posible determinar el tamaño de un elemento (conociendo, además, su naturaleza y el tipo de enlace que puede formar). De lo anterior se desprenden 3 conceptos distintos: Radio metálico, Radio covalente y Radio iónico. A pesar de esto, para determinar el tamaño de un átomo o especie química SIEMPRE deben considerarse 2 situaciones: El núcleo es capaz de atraer a los electrones, por lo tanto, la esfera puede contraerse (el tamaño disminuye). Los electrones siempre se repelen entre sí, por lo tanto hay una expansión de la nube electrónica (expansión de la esfera) y aumento en el tamaño. Ambas contribuciones de fuerza electrostática determinan el radio y tamaño de un elemento o ion.
- 8. 8 En general, el volumen de una esfera se obtiene conociendo su radio, de acuerdo con: π 34 V= r 3 Donde r es el radio del átomo o distancia entre núcleos o núcleo-electrón, según corresponda. Para los metales, el radio atómico es la mitad de la distancia entre los centros de los átomos adyacentes del metal Para los no metales, el radio observado es la mitad de la distancia entre los centros de los átomos en las moléculas diatómicas de los elementos.
- 9. 9 Variación del Radio de los átomos en el Sistema Periódico. En los períodos, el radio atómico disminuye hacia la derecha conforme aumenta el valor de Z. El factor que condiciona la disminución de los radios atómicos es el aumento de la carga nuclear efectiva (Zef), esto significa que los electrones más externos son atraídos fuertemente hacia el núcleo debido a que los electrones internos no los apantallan muy bien, por lo tanto, crece la carga positiva del núcleo (aumento de Z) conforme nos movemos a la derecha en un período. En palabras simples, a medida que aumenta el valor de Z en un período, mayor es la carga con la que el núcleo atrae a los electrones, y menor es el radio del átomo. Tomando como ejemplo los elementos del período 2, los valores experimentales para los radios de los átomos son: Li = 1,52 Å Be = 1,11 Å B = 0,77 Å C = 0,77 Å Nota: 1Å equivale a 10-10 metros En los grupos, el radio atómico aumenta conforme aumenta el valor de Z. En los grupos, al aumentar el valor de Z, hay un aumento en el número cuántico principal (n). El átomo presenta más niveles de energía con electrones y por lo tanto, la distancia entre el último electrón y el núcleo aumenta. En el grupo I-A se verifican los siguientes valores para los radios atómicos: Li = 1,52 Å Na = 1,86 Å K = 2,31 Å Rb = 2,44 Å Generalizando en el sistema periódico, la variación para el radio atómico es:
- 10. 10 Radio Iónico Los átomos pueden aceptar o perder electrones quedando cargados eléctricamente. Se define entonces radio iónico, como el tamaño de esos iones formados (sean cationes o aniones). Cuando se compara el tamaño de un ion respecto de su propio elemento se verifica que: El anión es siempre más grande que su propio elemento El catión siempre es más pequeño que su elemento Un ejemplo: Comparemos el catión estable del átomo de Sodio con su elemento: Na: 1s2 , 2s2 2p6 , 3s1 (3 niveles) Na+ : 1s2 , 2s2 2p6 (2 niveles) El átomo presenta más niveles energéticos que el ion El ion tiene menos electrones que el átomo El tamaño del átomo es mayor que el de su catión estable Por lo tanto: r Na+ r Na Ahora bien, al comparar el radio del cloro con su anión estable: Cl: 1s2 , 2s2 2p6 , 3s2 3p5 Cl- : 1s2 , 2s2 2p6 , 3s2 3p6 El átomo presenta igual número de niveles energéticos que el ion El ion tiene más electrones que el átomo La cantidad de protones en el núcleo es la misma para ambos La carga nuclear es mayor en el átomo El tamaño del iones mayor que el del átomo Por lo tanto: r Cl- > r Cl En general, en los grupos I-A y VII-A se cumple respectivamente que:
- 11. 11 ENERGÍA DE IONIZACIÓN O POTENCIAL DE IONIZACIÓN (P.I.) La energía de ionización de un átomo, corresponde a la energía mínima necesaria para sacar un electrón desde el estado fundamental o ion gaseoso. Para un átomo cualquiera como el sodio la energía de la primera ionización viene dada por: + - (g) (g)Na + P.I. Na + e En la Tabla periódica se verifica que mientras menos energía se necesite para arrancar un electrón a un átomo, menor será su valor de P.I (metales por ejemplo). Por el contrario, aquellos átomos con estabilidad energética (gases inertes) tienen los más altos valores de P.I, esto porque la estabilidad energética no le confiere capacidad al átomo para perder electrones. Por lo tanto, a mayor comportamiento metálico, menor será el valor para P.I de un elemento. Valores experimentales de energías de ionización en la Tabla Periódica: AFINIDAD ELECTRÓNICA (E.A) Y ELECTRONEGATIVIDAD (E.N) Los átomos no sólo pierden electrones para formar iones positivos, sino también los ganan formando aniones. La afinidad electrónica es una medida de la tendencia de un átomo a ganar un electrón. Cuanto mayor es la afinidad electrónica de un átomo, es más probable que se estabilice como anión. La afinidad electrónica se define (y determina experimentalmente) como la energía liberada cuando un átomo de una muestra gaseosa capta un electrón en su nivel más externo. - - (g) (g)A + e A + Energía Tanto los factores que la condicionan como su variación en el sistema periódico son homologables al P.I., esto quiere decir que; al avanzar en los períodos, el radio atómico decrece y el electrón que se agrega a la capa externa estará más cercano al núcleo, por consiguiente, se liberará más energía cuando se agregue un electrón.
- 12. 12 Al bajar en un grupo, en cambio, los radios de las capas aumentan porque el número cuántico principal es mayor. El electrón agregado está más lejos de la carga positiva del núcleo. En consecuencia, la cantidad de energía liberada cuando se agrega un electrón es menor. La electronegatividad es la tendencia que ejerce un átomo en una molécula para atraer electrones compartidos hacia su nube o densidad electrónica. A diferencia de la E.A, la E.N NO es una propiedad observable, es más bien un concepto generalizador que permite decidir hacia donde están desplazados los electrones enlazados en una molécula. La escala que clasifica a los átomos de acuerdo con su E.N, no tiene unidades. Linus Pauling en 1930, en base a los cálculos de energía de enlaces, postuló una escala donde le asignó el valor 4,0 al Flúor (el elemento más electronegativo) y el valor 0,7 para Cesio y Francio, elementos que presentan la menor atracción por un par electrónico enlazado. Variación en el sistema periódico: Valores de E.N para los elementos en el sistema periódico Los gases inertes no aparecen detallados puesto que no presentan valores para E.A y E.N
- 13. 13 RESUMEN Ejemplo oficial PSU (publicación DEMRE) ¿En cuál opción se expresa correctamente la relación de tamaño? A) N < N-3 B) Ca < Ca+2 C) Al < Al+3 D) Cl- < Cl E) Fe+2 < Fe+3 RESOLUCIÓN Para responder, es necesario tener presente que un ion negativo o anión se forma cuando un átomo capta uno o más electrones. La carga nuclear permanece constante, pero la carga nuclear efectiva sobre los electrones disminuye, lo que provoca que la fuerza de atracción sobre los electrones sea menor y las repulsiones aumenten, luego, los electrones se separan, haciendo finalmente que el tamaño del anión sea siempre mayor que el tamaño del átomo original. Por otra parte, un ion positivo o catión se forma cuando un átomo cede uno o más electrones, por lo que se produce un exceso de carga positiva con respecto a la carga negativa de los electrones. El núcleo atrae más a los electrones y aumenta la carga nuclear efectiva, por lo tanto, el tamaño de un catión es siempre menor que el tamaño del átomo original y como esto se relaciona con el número de electrones cedidos, cuanto mayor sea la carga del catión menor será su tamaño. Aplicando los fundamentos anteriores, es posible concluir que la única opción en la cual la relación de tamaño entre las especies es correcta es A.
- 14. 14 Ejemplo oficial PSU (publicación DEMRE) ¿Cuál opción representa mejor la variación del volumen atómico en el sistema periódico a medida que aumenta el número atómico? Grupo Período A) Aumenta Aumenta B) Aumenta Disminuye C) Disminuye No varía D) Disminuye Aumenta E) No varía Aumenta RESOLUCIÓN Para responder se necesita comprender cómo varían las propiedades periódicas, en grupos y períodos, con respecto al aumento del número atómico. En este caso, se debe analizar la variación que experimenta el volumen atómico. La tendencia del volumen atómico en un grupo, se puede determinar si se comprende que al aumentar el número atómico verticalmente en el sistema periódico, aumenta el número de niveles de energía y, por ende, el volumen atómico también aumenta. En un período se mantiene constante el número de niveles de energía, sin embargo, al aumentar el número atómico, aumenta el número de protones y de electrones. Los electrones internos ejercen un efecto pantalla (S) sobre los electrones más externos; esto se refiere a que los electrones internos bloquean parte de la carga nuclear o fuerzas atractivas nucleares que experimentan los electrones externos. El aumento en el número de electrones en los átomos de un mismo período aumenta levemente el efecto pantalla, ya que el número de electrones internos se mantiene constante y el aporte de los electrones vecinos es bajo, por lo que la carga nuclear efectiva (Zef) tiende a aumentar con el aumento de Z. El aumento de la carga nuclear efectiva provoca una contracción de los átomos, dando como resultado una disminución del volumen a medida que aumenta el número atómico en un período. La opción correcta es la B.
- 15. 15 TEST EVALUACIÓN Para la resolución de algunos ejercicios, se adjunta una parte de la Tabla Periódica de los Elementos. 1 H 1,0 Número atómico Masa atómica 2 He 4,0 3 Li 6,9 4 Be 9,0 5 B 10,8 6 C 12,0 7 N 14,0 8 O 16,0 9 F 19,0 10 Ne 20,2 11 Na 23,0 12 Mg 24,3 13 Al 27,0 14 Si 28,1 15 P 31,0 16 S 32,0 17 Cl 35,5 18 Ar 39,9 19 K 39,1 20 Ca 40,0 1. Considere la siguiente configuración electrónica extendida para un átomo 1s2 , 2s2 2p6 , 3s2 3p1 Al respecto, es correcto afirmar que el elemento I) posee en total 13 electrones. II) pertenece al grupo III-B. III) contiene 1 electrón de valencia. A) Solo I. B) Solo II. C) Solo III. D) Solo I y II. E) Solo II y III. 2. Si un átomo se ubica en el período 3, entonces es correcto afirmar que A) contiene 3 niveles de energía con electrones. B) presenta 3 electrones de valencia. C) contiene más de 20 electrones. D) es un elemento de transición. E) posee orbitales d con electrones.
- 16. 16 3. Un elemento ubicado en el grupo V-A presenta I) número atómico igual a 5. II) 3 electrones desapareados. III) configuración electrónica externa ns2 p3 . De las anteriores es (son) correcta(s) A) solo I. B) solo III. C) solo I y II. D) solo I y III. E) solo II y III. 4. ¿Cuál será la configuración electrónica correcta para la especie química 15Y-3 ? A) 1s2 , 2s2 2p6 , 3s2 3p6 B) 1s2 , 2s2 2p6 , 3s2 3p5 C) 1s2 , 2s2 2p6 , 3s1 3p3 D) 1s2 , 2s2 2p6 , 3s1 E) 1s1 , 2s2 2p6 , 3s2 5. ¿Cuál de los siguientes elementos se ubica en el período 3 y presenta (en estado basal) 2 electrones desapareados? A) 12X B) 14Y C) 18Z D) 20W E) 8R 6. Los elementos halógenos se caracterizan por tener I) comportamiento metálico. II) configuración electrónica externa del tipo ns2 p4 . III) 7 electrones en el nivel de valencia. De las anteriores es (son) correcta(s) A) solo I. B) solo II. C) solo III. D) solo I y II. E) I, II y III.
- 17. 17 7. En la siguiente lista de especies químicas, ¿cuál presenta mayor tamaño? A) 10X0 B) 7Y-3 C) 13Z+3 D) 11W+1 E) 9R-1 8. Respecto del Helio (He) se afirma lo siguiente I) presenta un altísimo valor para el potencial de ionización. II) es el átomo con menor tamaño en el sistema periódico. III) se le considera un gas con configuración electrónica 1s2 . De las anteriores es (son) correcta(s) A) solo I. B) solo III. C) solo I y II. D) solo II y III. E) I, II y III. 9. ¿Cuál de los siguientes elementos presenta mayor afinidad electrónica? A) Hidrógeno B) Nitrógeno C) Helio D) Flúor E) Calcio 10. El Cloro (17Cl) es un elemento que puede estabilizarse electrónicamente adoptando cargas eléctricas A) +1 y -7 B) -1 y +8 C) -1 y +7 D) +3 y -2 E) -7 y +4
- 18. 18 11. Si el ion X-2 presenta la siguiente configuración electrónica 1s2 , 2s2 2p6 , 3s2 3p6 Entonces el grupo y periodo del elemento en el sistema periódico será Período Grupo A) 6 IV – B B) 3 VIII – A C) 6 IV – A D) 3 VI – B E) 3 VI – A 12. Respecto de un átomo se conoce la siguiente información: Es un metal diamagnético. Se ubica en el período 4. Tiene sólo 2 electrones en el nivel de mayor energía. De lo anterior, se deduce que el elemento debe ser A) Neón. B) Magnesio. C) Berilio. D) Calcio. E) Sodio. 13. Las siguientes son las configuraciones electrónicas para 2 átomos (X e Y) en estado fundamental X: 1s2 , 2s2 2p4 Y: 1s2 , 2s1 Al respecto, es correcto afirmar que ambos I) son metales. II) presentan igual valor de Z. III) son elementos representativos. A) Solo I. B) Solo III. C) Solo I y II. D) Solo I y III. E) I, II y III.
- 19. 19 14. ¿Cuál(es) de las siguientes propiedades periódicas aumenta(n) cuando aumenta el número atómico en un período? I) Potencial de ionización II) Electronegatividad III) Radio atómico A) Solo I. B) Solo II. C) Solo III. D) Solo I y II. E) I, II y III. 15. Si un elemento presenta en el nivel de valencia la siguiente configuración electrónica 3s2 3px 2 3py 1 3pz 1 Entonces, el grupo al que pertenece y su valor de Z serán Grupo Z A) VI-A 14 B) VI-A 16 C) VII-A 15 D) VII-B 14 E) II-A 16 DMQ-QC03 Puedes complementar los contenidos de esta guía visitando nuestra Web http://www.pedrodevaldivia.cl/