Gravimetría
- 1. Gravimetría Análisis Gravimétrico I.Q. Manuel Arturo Caballero Rdz. Campus Monterrey Norte Universidad del Valle de México Escuela de Ciencias de la Salud Químico Farmaco Biotecnólogo Química Analítica I
- 2. Gravimetría • Conjunto de técnicas de análisis en las que se mide la masa de un producto para determinar la masa de un analito presente en una muestra. • Se cuentan entre los métodos más exactos de la Química Analítica Cuantitativa.
- 3. Gravimetría • Los métodos gravimétricos revistan entre los más antiguos de la Química Analítica, pero mantienen su vigencia en la actualidad. • Constituyen análisis claves en el control de calidad de medicamentos y otros productos de uso humano.
- 4. Ubicación en la Química Analítica • Métodos Gravimétricos: medición del peso de un sólido. • Métodos Volumétricos: medición de un volumen. • Métodos Instrumentales: medición de una propiedad física con aparatos.
- 5. Gravimetría • Acoplados con métodos modernos de separación como la cromatografía de gases, constituyen una poderosa arma de doble propósito: análisis cualitativo y cuantitativo.
- 6. Clasificación • Métodos de precipitación: Se separa al analito de la muestra mediante la formación de un precipitado insoluble. • Métodos de volatilización: Se separa al analito mediante destilación o sublimación, para posteriormente pesar el producto o medir la pérdida de peso de la muestra.
- 7. Métodos de Volatilización • M. de Volatilización Directo: La sustancia volátil se recoge en un adsorbente adecuado y se pesa. • M. de Volatilización Indirecto: Se basa en la pérdida de peso sufrida por la muestra inicial y se aplica cuando el agua es el único componente volátil.
- 8. Métodos de Precipitación Es requisito que el precipitado que se obtenga: • Sea muy insoluble. • Sea fácilmente filtrable. • Sea muy puro. • Sea de composición conocida y constante.
- 9. Productos de una precipitación • Cristales: Cuerpo sólido de disposición geométrica de sus partículas constituyentes (átomos, moléculas, iones) que pueden crecer significativamente. • Coloides: Partículas, de naturaleza cristalina o no, cuyos diámetros oscilan entre 1 y 100 nm, que permanecen indefinidamente en suspensión y atraviesan la mayoría de los filtros.
- 10. Crecimiento cristalino • Tiene 2 etapas: • Nucleación: Las moléculas en solución se reúnen de manera aleatoria y forman pequeños núcleos. • Crecimiento de partículas: La adición de más moléculas al núcleo para formar un cristal.
- 11. Crecimiento cristalino • Cuando una solución contiene más soluto del que debería estar presente en el equilibrio, se dice que la solución está sobresaturada. • La sobresaturación relativa (SSR) se expresa: SSR = (Q – S) / S Q es la [soluto] realmente presente S es la [soluto] en el equilibrio
- 12. Crecimiento cristalino • Se ha encontrado que la velocidad de nucleación depende más de la sobresaturación relativa que la misma rapidez de crecimiento de partículas.
- 13. Crecimiento cristalino • Eso significa que en una solución altamente sobresaturada, la nucleación ocurre con mayor velocidad que el crecimiento de partículas. • El resultado: suspensión con partículas muy pequeñas, o peor aún, un coloide.
- 14. Crecimiento cristalino • En una solución menos sobresaturada, la nucleación no ocurre tan rápido y los núcleos tienen la posibilidad de crecer para formar partículas más grandes y manejables.
- 15. Cómo reducir la sobresaturación • Elevar la Temp para incrementar la solubilidad. • Agregar con lentitud el reactivo precipitante, agitando para no crear zonas de alta sobresaturación. • Utilizar volúmenes grandes de solución, para que las [analito] y [precipitante] sean bajas.
- 16. Solubilidad • Disminuye cuando la temperatura baja. • La solubilidad de las sales orgánicas puede aumentarse si se utilizan solventes cuya polaridad sea menor que la del agua. • En general los precipitados de muy baja solubilidad se forman como coloides (muchos sulfuros e hidróxidos).
- 17. Tipos de aguas • Agua esencial: Forma parte integral de la estructura molecular o cristalina de un compuesto sólido. • Agua no esencial: Se retiene en el sólido como consecuencia de fuerzas físicas.
- 18. Agua esencial • Agua de cristalización: Se encuentra dentro de las redes de los cristales pero no se haya unida de manera covalente a ninguna molécula o ión: BaCl2·2H2O • Agua de constitución: Se presenta en compuestos que dan cantidades estequiométricas de agua cuando se calientan o descomponen: Ca(OH)2 CaO + H2O
- 19. Agua no esencial • Agua higroscópica: Se encuentra en la superficie de las partículas del material, muy típico de sustancias finamente divididas. • Agua ocluída: Se encuentra atrapada al azar en las oquedades microscópicas de los sólidos, en particular de minerales y rocas.
- 20. Pasos comunes de un método Gravimétrico de Precipitación • Toma de muestra. • Preparación de la muestra. • Disolución de la muestra. • Precipitación. • Filtración. • Lavado del precipitado. • Secado y calcinación. • Cálculos e interpretación.
- 21. Pasos comunes de un método Gravimétrico 1. Toma de muestra. Tiene que ser representativa del total.
- 22. Pasos comunes de un método Gravimétrico 2. Preparación de la muestra. a) Pulverizar b) Homogenizar c) Secar (temperatura > 100 °C) d) Pesar exactamente
- 23. Pasos comunes de un método Gravimétrico 3. Disolución de la muestra. Que se disuelva totalmente y que no interfiera en el análisis. El solvente de elección cuando se puede es agua. Las aleaciones y minerales pueden requerir ácidos, álcalis, etc.
- 24. Pasos comunes de un método Gravimétrico 3. Disolución de la muestra. Muestra Tratamiento Sales solubles Agua Aleaciones ferrosas HCl, HNO3 Rocas de carbonatos HCl Rocas de silicatos Fusión con Na2CO3 Minerales de hierro HCl con SnCl2
- 25. Pasos comunes de un método Gravimétrico 4. Precipitación Consiste en la formación en el seno de un líquido, de un sólido que contenga el elemento o radical por cuantear. Toda precipitación se hace calentando previamente el líquido a una T próxima a la eb., adicionando el reactivo poco a poco, en exceso y agitando.
- 26. Pasos comunes de un método Gravimétrico 5. Filtración. El objetivo es obtener un precipitado libre de agua o de cualquier otro líquido y en una forma química estable y de composición definida.
- 27. Pasos comunes de un método Gravimétrico 6. Lavado del precipitado Debe hacerse con varias pequeñas porciones del líquido y no con una sola porción grande.
- 28. Pasos comunes de un método Gravimétrico 7. Secado y calcinación del precipitado El objetivo es obtener un precipitado libre de agua o de cualquier otro líquido y en una forma química estable y de composición definida.
- 29. Detalles de la precipitación • Con frecuencia las suspensiones coloidales pueden coagularse por calentamiento, agitación y por la adición de un electrolito. • La peptización es un proceso mediante el cual un coloide coagulado regresa a su estado disperso.
- 30. Detalles de la precipitación • La peptización puede ocurrir cuando se hace un lavado al coagulado coloide, porque remueve el electrolito que lo mantiene unido. • La solución para lograr un lavado y no caer en peptización es lavar con una disolución que contenga un electrolito que se volatilice después.
- 31. Contaminación de precipitados • Coprecipitación: Arrastre de partículas solubles en solución por el precipitado recién formado. • Postprecipitación: Formación de un segundo precipitado después de formar el precipitado analítico. Se presenta cuando un ion es capaz de precipitar con el mismo reactivo precipitante.
- 32. 3 tipos de Coprecipitación • Por adsorción superficial: el ↓ queda como partículas coloidales (con carga) por lo que adsorbe impurezas también cargadas. • Por oclusión (atrapamiento mecánico): cuando las impurezas quedan atrapadas al crecer el precipitado. • Por formación de cristales mixtos: alguno de los iones de la red cristalina se sustituye por otro elemento de tamaño y carga similar.
- 33. Purificación de precipitados • Digestión: Calentamiento lento y prolongado del precipitado en la solución madre para aumentar el tamaño de partícula. • Reprecipitación: El sólido filtrado se vuelve a disolver y se reprecipita. El precipitado final tendría una fracción menor del contaminante en el disolvente original. [Fe(OH)3 y Al(OH)3]
- 34. Detalles de la precipitación • La precipitación homogénea es un proceso en el cual se forma un precipitado por la generación lenta y homogénea de un reactivo precipitante en la solución. • Los sólidos obtenidos así, tienen mayor pureza y son más fáciles de filtrar.
- 35. Secado & Calcinación • El precipitado se calienta hasta que su masa se vuelve constante. • El calor elimina el disolvente y cualquier especie volátil arrastrada con el precipitado. • El precipitado mismo se descompone a otro compuesto de composición conocida, llamado su “forma pesable”.
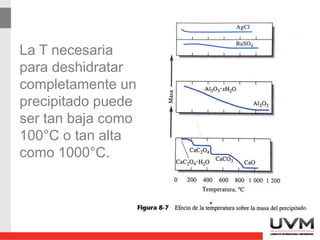
- 36. La T necesaria para deshidratar completamente un precipitado puede ser tan baja como 100°C o tan alta como 1000°C.
- 38. Humedad en granos y semillas • http://tpmequipos.com/932395_468- Medidor-de-Humedad-Granos-con- dosificador-.html • http://www.agroterra.com/p/analizador-de- peso-y-humedad-de-granos-y-semillas- granomat-desde-barcelona- 3020139/3020139
- 39. Aplicaciones de Gravimetría • Determinación de lactosa en productos lácteos. • Determinación de salicilatos en fármacos. • Determinación de Fenolftaleína en laxantes. • Determinación de Nicotina. • Determinación de colesterol.











![Crecimiento cristalino
• Cuando una solución contiene más soluto del
que debería estar presente en el equilibrio,
se dice que la solución está sobresaturada.
• La sobresaturación relativa (SSR) se
expresa:
SSR = (Q – S) / S
Q es la [soluto] realmente presente
S es la [soluto] en el equilibrio](https://image.slidesharecdn.com/gravimetra-131223010310-phpapp02/85/Gravimetria-11-320.jpg)



![Cómo reducir la
sobresaturación
• Elevar la Temp para incrementar la
solubilidad.
• Agregar con lentitud el reactivo
precipitante, agitando para no crear zonas
de alta sobresaturación.
• Utilizar volúmenes grandes de solución,
para que las [analito] y [precipitante] sean
bajas.](https://image.slidesharecdn.com/gravimetra-131223010310-phpapp02/85/Gravimetria-15-320.jpg)

















![Purificación de precipitados
• Digestión: Calentamiento lento y prolongado
del precipitado en la solución madre para
aumentar el tamaño de partícula.
• Reprecipitación: El sólido filtrado se vuelve a
disolver y se reprecipita. El precipitado final
tendría una fracción menor del contaminante
en el disolvente original. [Fe(OH)3 y Al(OH)3]](https://image.slidesharecdn.com/gravimetra-131223010310-phpapp02/85/Gravimetria-33-320.jpg)