Enlaces quimicos
- 2. LAS PROPIEDADES CARACTERÍSTICAS DE LAS SUSTANCIAS ESTÁN RELACIONADAS CON LA FORMA EN QUE ESTÁN UNIDAS SUS PARTÍCULAS Y LAS FUERZAS ENTRE ELLAS, ES DECIR, CON EL TIPO DE ENLACE QUE EXISTE ENTRE SUS PARTÍCULAS.
- 3. CLASIFICACIÓN DE LOS ELEMENTOS DE ACUERDO CON LA REGLA DEL OCTETO Metales: baja electronegatividad, baja energía de ionización. Tienden a soltar electrones. No metales: alta electronegatividad. Tienden a coger electrones
- 4. SEGÚN EL TIPO DE ÁTOMOS QUE SE UNEN: Metal – No metal: uno cede y otro coge electrones (cationes y aniones) No metal – No metal: ambos cogen electrones, comparten electrones Metal – Metal: ambos ceden electrones
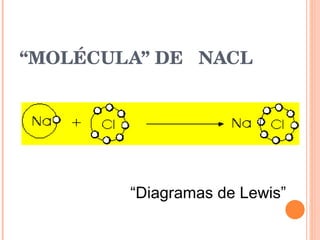
- 6. “ MOLÉCULA” DE NACL “ Diagramas de Lewis”
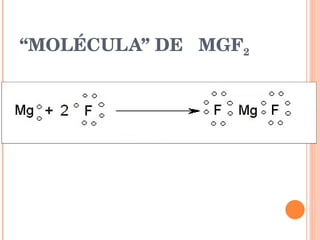
- 7. “ MOLÉCULA” DE MGF 2
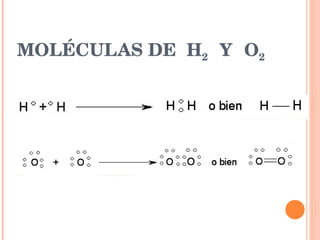
- 8. MOLÉCULAS DE H 2 Y O 2
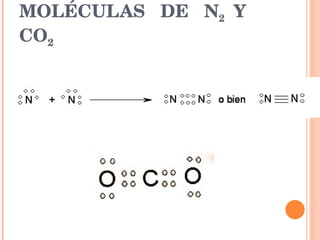
- 9. MOLÉCULAS DE N 2 Y CO 2
- 10. TIPOS DE ENLACE Iónico Metálico Covalente
- 11. ENLACE IÓNICO El compuesto iónico se forma al reaccionar un metal con un no metal . Los átomos del metal pierden electrones (se forma un catión) y los acepta el no metal (se forma un anión). Los iones de distinta carga se atraen eléctricamente, se ordenan y forman una red iónica. Los compuestos iónicos no están formados por moléculas.
- 12. ENLACE IÓNICO ENTRE CL Y NA: FORMACIÓN DEL IÓN CL - Y NA +
- 13. PROPIEDADES COMPUESTOS IÓNICOS Elevados puntos de fusión y ebullición Solubles en agua No conducen la electricidad en estado sólido, pero sí en estado disuelto o fundido (Reacción química: electrolisis ) Al intentar deformarlos se rompe el cristal (fragilidad)
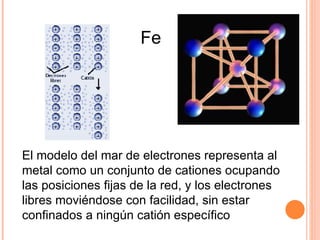
- 14. ENLACE METÁLICO Las sustancias metálicas están formadas por átomos de un mismo elemento metálico (baja electronegatividad). Los átomos del elemento metálico pierden algunos electrones, formándose un catión o “ resto metálico ”. Se forma al mismo tiempo una nube o mar de electrones: conjunto de electrones libres, deslocalizados, que no pertenecen a ningún átomo en particular. Los cationes se repelen entre sí, pero son atraídos por el mar de electrones que hay entre ellos. Se forma así una red metálica: las sustancias metálicas tampoco están formadas por moléculas.
- 15. El modelo del mar de electrones representa al metal como un conjunto de cationes ocupando las posiciones fijas de la red, y los electrones libres moviéndose con facilidad, sin estar confinados a ningún catión específico Fe
- 16. PROPIEDADES SUSTANCIAS METÁLICAS Elevados puntos de fusión y ebullición Insolubles en agua Conducen la electricidad incluso en estado sólido (sólo se calientan: cambio físico). La conductividad es mayor a bajas temperaturas. Pueden deformarse sin romperse
- 17. ENLACE COVALENTE Los compuestos covalentes se originan por la compartición de electrones entre átomos no metálicos. Electrones muy localizados.
- 18. DIFERENTES TIPOS DE ENLACE COVALENTE Enlace covalente normal : Simple Múltiple: doble o triple Polaridad del enlace: Apolar Polar Enlace covalente dativo o coordinado
- 19. ENLACE COVALENTE NORMAL Si se comparten un par de e - : enlace covalente simple Si se comparten dos pares de e - : enlace covalente doble Si se comparten tres pares de e - : enlace covalente triple
- 20. POLARIDAD DEL ENLACE COVALENTE Enlace covalente apolar : entre átomos de idéntica electronegatividad (H 2 , Cl 2 , N 2 …). Los electrones compartidos pertenencen por igual a los dos átomos. Enlace covalente polar : entre átomos de distinta electronegatividad (HCl, CO…). Los electrones compartidos están más desplazados hacia el átomo más electronegativo. Aparecen zonas de mayor densidad de carga positiva ( δ +) y zonas de mayor densidad de carga negativa ( δ -)
- 21. ENLACE COVALENTE DATIVO O COORDINADO Cuando el par de electrones compartidos pertenece sólo a uno de los átomos se presenta un enlace covalente coordinado o dativo . El átomo que aporta el par de electrones se llama donador (siempre el menos electronegativo) y el que los recibe receptor o aceptor (siempre el más electronegativo)
- 22. ENLACE DE ÁTOMOS DE AZUFRE (S) Y OXÍGENO (O) Molécula de SO : enlace covalente doble Molécula de SO 2 : enlace covalente doble y un enlace covalente coordinado o dativo Molécula de SO 3 : enlace covalente doble y dos enlaces covalentes coordinado o dativo :S ═ O: ˙ ˙ ˙ ˙ ˙ ˙ S ═ O: ˙ ˙ :O ← ˙ ˙ ˙ ˙ S ═ O: ˙ ˙ :O ← ˙ ˙ ˙ ˙ ↓ :O: ˙ ˙