Tlv bond valence theory
- 1. Teoria da Ligação deTeoria da Ligação de Valência (TLV)Valência (TLV) • Teoria de Lewis – não prevê a geometria das moléculas, limitação a moléculas que respeitem a regra do octeto. • A idéia central da TLV vem do entrosamento dos orbitais de cada átomo para formar ligações químicas.
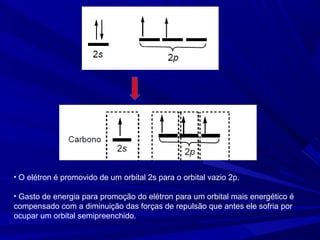
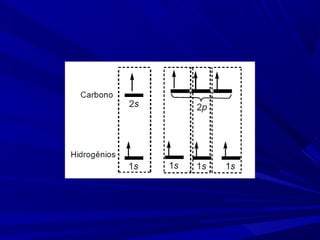
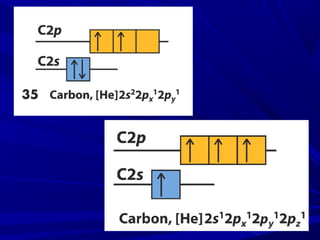
- 2. Carbono – [He] 2s2 , 2p2 Como explicar a tendência do carbono em formar compostos tetravalentes? PROMOÇÃO DE ELÉTRONS
- 3. • O elétron é promovido de um orbital 2s para o orbital vazio 2p. • Gasto de energia para promoção do elétron para um orbital mais energético é compensado com a diminuição das forças de repulsão que antes ele sofria por ocupar um orbital semipreenchido.
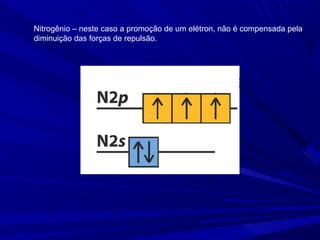
- 4. Nitrogênio – neste caso a promoção de um elétron, não é compensada pela diminuição das forças de repulsão.
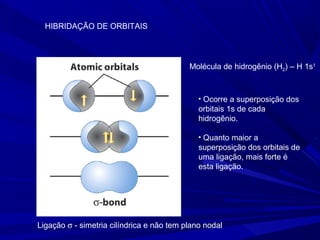
- 5. Molécula de hidrogênio (H2) – H 1s1 Ligação σ - simetria cilíndrica e não tem plano nodal • Ocorre a superposição dos orbitais 1s de cada hidrogênio. • Quanto maior a superposição dos orbitais de uma ligação, mais forte é esta ligação. HIBRIDAÇÃO DE ORBITAIS
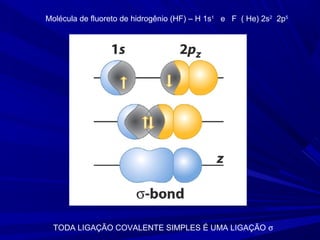
- 6. Molécula de fluoreto de hidrogênio (HF) – H 1s1 e F ( He) 2s2 2p5 TODA LIGAÇÃO COVALENTE SIMPLES É UMA LIGAÇÃO σ
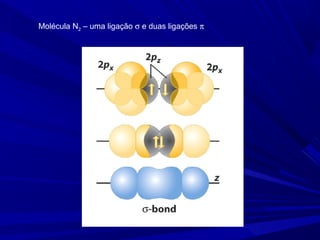
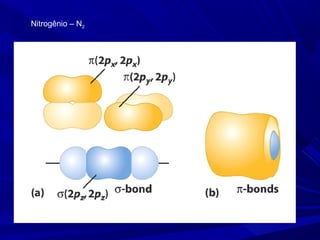
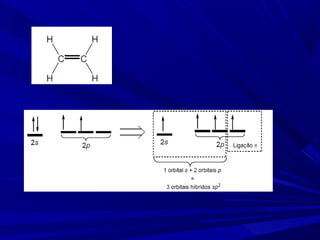
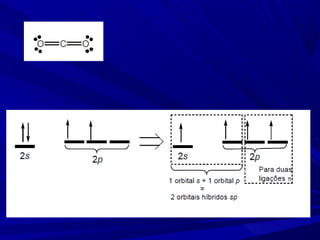
- 7. Molécula N2 – uma ligação σ e duas ligações π
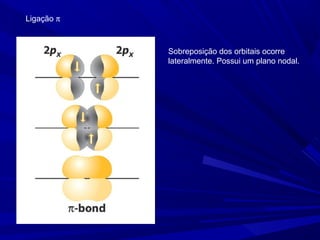
- 8. Ligação π Sobreposição dos orbitais ocorre lateralmente. Possui um plano nodal.
- 10. Uma ligação simples é uma ligação σ. Uma ligação dupla é uma ligação σ e mais uma ligação π. Uma ligação tripla é uma ligação σ e mais duas ligações π Na teoria da ligação de valência, supomos que as ligações formam quando elétrons desemparelhados de orbitais atômicos da camada de valência formam pares. Os orbitais atômicos que eles ocupam se sobrepõem para formar ligações σ ou π.
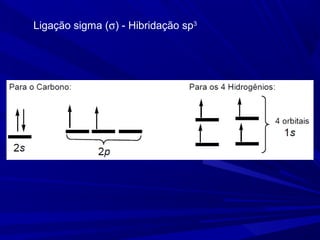
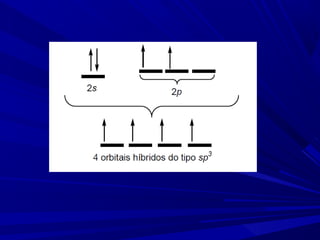
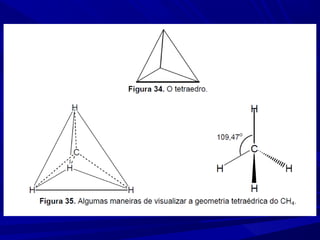
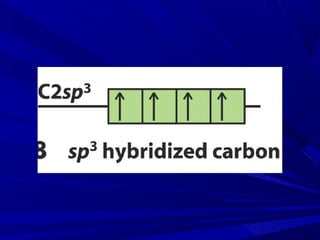
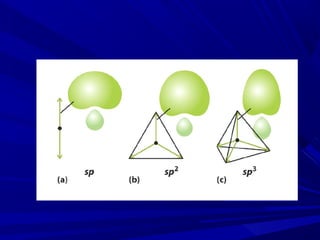
- 11. Ligação sigma (σ) - Hibridação sp3
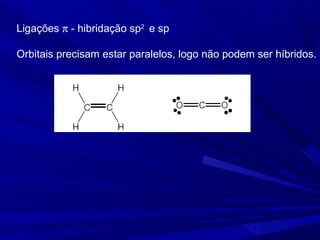
- 17. Ligações π - hibridação sp2 e sp Orbitais precisam estar paralelos, logo não podem ser híbridos.
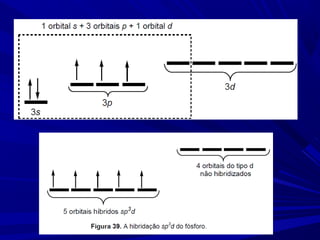
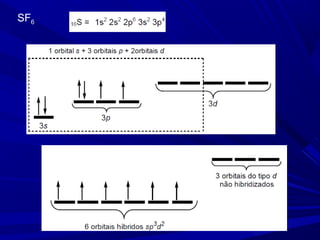
- 21. Expansão do octeto Tanto o PCl5 como o SF6 são exemplos de compostos onde o átomo central ultrapassa o número de ligações esperadas pela regra do octeto. A partir do 3º. período, o subnível d começa, estando disponível para hibridizar com os orbitais 3s e 3p do fósforo. ÁTOMOS QUE TENHAM ORBITAIS d VAZIOS EM SUAS CAMADAS DE VALÊNCIA PODEM USÁ-LOS PARA FAZER UM NÚMERO MAIOR DE LIGAÇÕES.
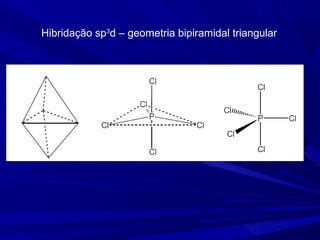
- 23. Hibridação sp3 d – geometria bipiramidal triangular
- 24. SF6
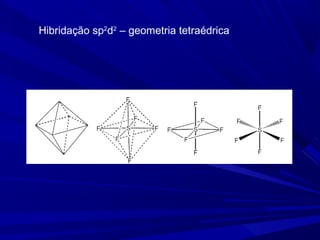
- 25. Hibridação sp2 d2 – geometria tetraédrica

![Carbono – [He] 2s2
, 2p2
Como explicar a tendência do carbono em formar compostos tetravalentes?
PROMOÇÃO DE ELÉTRONS](https://image.slidesharecdn.com/tlv-bondvalencetheory-181121182508/85/Tlv-bond-valence-theory-2-320.jpg)