Hibridização de orbitais atômicos
- 1. UNIVERSIDADE FEDERAL DO PARÁ INSTITUTO DE CIÊNCIAS DA SAÚDE FACULDADE DE FARMÁCIA KAROLINE LEITE CUNHA Mat.: 11030005901 ESTRUTURA, PROPRIEDADE E REATIVIDADE DOS FARMACOS I Prof. Dr. Agnaldo Hibridação de Orbitais Atômicos. BELÉM – PARÁ 2014
- 2. Sumário Hibridização dos Orbitais Atômicos .......................................................................................2 o Introdução................................................................................................................2 o Hibridização do Boro .................................................................................................5 o Hibridização do Oxigênio ...........................................................................................8 o Hibridação do Nitrogênio...........................................................................................9 o Hibridação do Enxofre .............................................................................................11 Referencias Bibliográficas ...................................................................................................12
- 3. Hibridização dos Orbitais Atômicos o Introdução De acordo com o modelo da mecânica quântica de um átomo, o comportamento de um elétron específico em um átomo pode ser descrito pela expressão matemática denominada equação de onda – o mesmo tipo de expressão usado para descrever o movimento das ondas em fluidos. A solução de uma equação de onda é denominada função de onda, ou orbital, e é descrita pela letra grega psi, . Quando o quadrado da função de onda 2 é expresso em um espaço tridimensional, o orbital descreve o volume do espaço em volta do núcleo onde o elétron tem maior probabilidade de ser encontrado. Entretanto, você pode pensar em um orbital como uma fotografia do elétron sendo tirada a uma velocidade lenta. Tal fotografia mostraria o orbital como uma nuvem borrada indicando a região do espaço em volta do núcleo onde o elétron estava. Essa nuvem eletrônica não tem uma fronteira bem-definida, mas por questões de praticidade podemos fixar os limites dizendo que um orbital representa o espaço onde o elétron passa a maior parte do tempo (90%). Quais as formas de um orbital? Existem quatro tipos diferentes de orbitais, denominados s, p, d e f. Dos quatro, os mais importantes para química orgânica são os orbitais s e p. Sendo que o orbital p se distribui em três eixos o px, py e pz. Esta delimitação de orbitais permitiu uma melhor compreensão das ligações químicas, definindo a chamada teoria do orbital atômico. Esta teoria permite s Orbitais atômicos s e p.
- 4. determinar quantas ligações um átomo pode realizar, sendo esta determinada pelo número de elétrons no orbital da camada de valência (ultima camada ou camada externa). Como por exemplo a distribuição eletrônica do flúor, com dois pares completos e um elétrons desemparelhado, indicando que o flúor necessita de mais um elétron para se estabilizar (regra do octeto). Apesar das teorias de Lewis e Kössel permitirem determinar como as ligações químicas ocorrem, ela não explicava porque o carbono com uma distribuição eletrônica 1s2, 2s2, 2p2 poderia fazer quatro ligações químicas, sendo que o átomo de carbono somente teria dois elétrons desemparelhados (consequentemente duas ligações). Para explicar as quatro ligações do carbono, foi necessária uma outra teoria, denominada teoria do orbital molecular, que propunha que as ligações químicas seriam realizadas pela união dos orbitais de cada átomo e estes poderiam se modificar (unindo orbitais) formando orbitais chamados híbridos. O composto orgânico mais simples é o gás metano CH4. Para satisfazer a Valência de todos os cinco átomos, os hidrogênios devem ligar-se ao carbono por meio de ligações simples, denominadas Ligações sigma (). No estado fundamental, a configuração eletrônica do átomo de carbono é 1s2 2s2 2p2. Com essa distribuição eletrônica, o carbono não é capaz de se ligar a quatro átomos de hidrogênio, mas apenas a dois. Se, no entanto, um elétron do orbital 2s for transferido para o orbital 2pz vazio, o carbono passará a ter quatro elétrons desemparelhados (estado excitado), sendo, portanto, capaz de fazer quatro ligações. Desse modo, explica-se a tetra valência do átomo de carbono. Porém, se os átomos de hidrogênio se ligassem aos orbitais 2s, 2px, 2py e 2pz, os ângulos entre as ligações H-C-H não seriam de 109,47º, (tetraedro), pois o ângulo entre os orbitais p é de 90º. Também não seriam iguais todos os comprimento das ligações C-H, pois o orbital 2s possui raio diferente dos orbitais 2p. O que acontece, na 2s 2px 2py 2pz
- 5. NO verdade, é uma hidridação dos orbitais s e p, dando origem a quatro novos orbitais denominados híbridos sp3. Esses orbitais são todos iguais, e o ângulo entre eles é de 109,47º. Como na molécula de metano, todo carbono que se encontrar ligado a quatro ou seja, geometria tetraédrica. Tetracloreto de carbono, por exemplo, tem a mesma geometria do metano. Além do carbono, outros elementos como o oxigênio e o nitrogênio também podem ter hibridação sp3. Nestes dois casos, as distribuições eletrônicas antes e depois da hibridação dos orbitais são as seguintes: Hibridização sp3 do átomo de oxigênio e nitrogênio. Nota: o átomo de oxigênio possui dois pares de elétrons desparelhados e o nitrogênio apenas um. Fonte: Medeiros, R. I. Apostila: Introdução à Química Orgânica. Hibridação sp3 1s 2s 2px 2py 2pz 1s 2sp3 O N Hibridação sp3 1s 2s 2px 2py 2pz 1s 2sp3 O N
- 6. o Hibridização do Boro A hibridização do boro é do tipo sp2, o que explica o porquê desse elemento conseguir realizar três ligações covalentes. A Teoria da Hibridização surgiu como um complemento à Teoria do Octeto, conseguindo explicar a estrutura de um número maior de moléculas, incluindo moléculas formadas pelo boro (B). Esse elemento possui cinco elétrons no estado fundamental, com a seguinte configuração eletrônica: Pela teoria do octeto, o boro poderia realizar somente uma ligação covalente, pois ele possui somente um orbital atômico incompleto. No entanto, experimentalmente, nota-se que esse elemento forma compostos em que ele realiza mais de uma ligação. Um exemplo é o trifluoreto de boro (BF3). Como mostrado abaixo, o boro realiza três ligações covalentes com o flúor, compartilhando três pares de elétrons e ficando com seis elétrons na sua última camada (camada de valência), ou seja, uma exceção à regra do octeto. Isso é explicado pelo fenômeno da hibridização que ocorre com o boro. Acontece que um elétron do subnível 2s absorve energia e passa para o estado excitado, no qual ele salta para um orbital vazio do subnível 2p. Formam-se, desse modo, três orbitais incompletos, que podem agora realizar três ligações covalentes:
- 7. Porém, as ligações formadas no trifluoreto de boro são todas iguais, mas se observarmos acima, são duas ligações diferentes, uma vez que uma delas seria feita por meio de um orbital do tipo s e as outras duas por meio de um orbital do tipo p. É aqui que ocorre a hibridização, ou seja, os orbitais incompletos fundem-se, originando três orbitais híbridos ou hibridizados, que são idênticos e diferentes dos originais:
- 8. Visto que esses orbitais híbridos são formados por um orbital s e dois orbitais p, essa hibridização é chamada de Hibridização sp². O flúor que se liga ao boro possui nove elétrons. Sua distribuição eletrônica e seus orbitais são mostrados a seguir: Cada átomo de flúor pode realizar somente uma ligação covalente e que o orbital que realiza essa ligação é do tipo p. Assim, observe a seguir como fica a conformação dos orbitais ao se realizar as ligações que formam o BF3 e veja como as ligações são idênticas, do tipo σp-sp2:
- 9. o Hibridização do Oxigênio No oxigénio (configuração electrónica 2s22p4), duas das quatro orbitais de valência estão ocupadas com pares de elétrons não partilhados (que podem participar em ligações covalente dativas) e as duas restantes estabelecem ligações covalentes «normais». A molécula de H2O é uma molécula que apresenta geometria angular e em que o oxigénio estabelece duas ligações equivalentes com os átomos de hidrogénio. Recorrendo à Teoria de Orbitais Moleculares para descrever esta molécula obtêm-se orbitais moleculares obtidas por combinação linear de todas as orbitais atómicas dos átomos constituintes, isto é, tal como o carbono no metano e o azoto na amónia, na água o oxigénio apresenta hibridação sp3 e uma configuração electrónica: [He] sp3 2sp3 2sp3 1sp3 1. Duas das orbitais híbridas sp3 correspondem assim a dois pares de electrões não partilhados e apresentam sobreposição máxima com a orbital 1s de cada um dos hidrogénios. A água é descrita pelo enlace de valência como apresentando dois pares de electrões não partilhado e duas ligações σ (localizadas) resultantes da sobreposição ou enlace topo a topo das orbitais 1s do hidrogénio com as orbitais híbridas sp3 do oxigénio.
- 10. Na molécula da água ocorrem dois tipos de repulsões, uma entre os pares de elétrons não ligantes e outra entre os elétrons não ligantes e os elétrons de ligação. Para diminuir a repulsão eletrônica o ângulo entre os orbitais passa para 105°. A nova geometria molecular é denominada de angular. o Hibridação do Nitrogênio A amónia e a água, NH3 e H2O, respectivamente, são os exemplos mais simples de moléculas poliatómicas em que o átomo central apresenta pares de elétrons não partilhados e hibridação sp3. Quando isso acontece, a estrutura tridimensional da molécula é diferente da encontrada para o metano embora a geometria das orbitais permaneça tetraédrica. O azoto (configuração electrónica 2s22p3) tem quatro orbitais de valência e cinco elétrons para as preencher. Assim, uma das orbitais do azoto está ocupada com um par de elétrons não partilhado (que pode ser utilizado numa ligação covalente dativa) e estabelece três ligações covalentes. A molécula de NH3 é uma molécula que apresenta geometria piramidal e em que o azoto estabelece três ligações equivalentes com os átomos de hidrogénio. Recorrendo à Teoria de Orbitais Moleculares para descrever esta molécula obtêm-se orbitais moleculares obtidas por combinação linear de todas as orbitais atómicas dos átomos
- 11. constituintes, isto é, tal como o carbono no metano, o azoto na amónia apresenta hibridação sp3 e uma configuração electrónica: [He]sp3 2sp3 1sp3 1sp3 1. Três das orbitais híbridas sp3 apresentam sobreposição máxima com a orbital 1s de cada um dos hidrogénios e a restante corresponde a um par de elétrons não partilhado. A amónia é descrita como apresentando um par de elétrons não partilhado e três ligações σ (localizadas) resultantes da sobreposição ou enlace topo a topo das orbitais 1s do hidrogénio com as orbitais híbridas sp3 do azoto. A repulsão entre os elétrons não ligantes e os elétrons de repulsão faz com que o ângulo de 109° 28’ (109,5°) diminua para 107°. A nova geometria formada é piramidal e permite a molécula maior estabilidade. O nitrogênio com hibridação sp3 está presente nos compostos orgânicos nitrogenados, que são representados pelas aminas primárias, secundárias e terciárias.
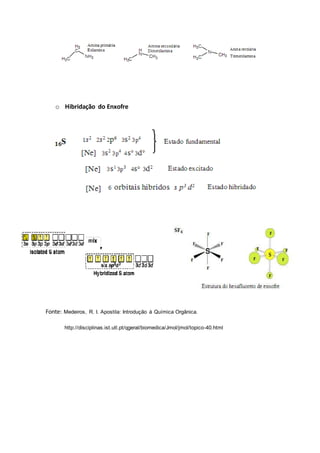
- 12. o Hibridação do Enxofre Fonte: Medeiros, R. I. Apostila: Introdução à Química Orgânica. http://disciplinas.ist.utl.pt/qgeral/biomedica/Jmol/jmol/topico-40.html
- 13. Referencias Bibliográficas 1- Medeiros, R. I. Apostila: Introdução à Química Orgânica. Disponível em: < http:// http://www.fug.edu.br/adm/site_professor/arq_download/arq_1120.doc>. Acesso em: 12 mar. 2014. 2- Instituto Superior Técnico. Química Geral. Disponível em: < http://disciplinas.ist.utl.pt/qgeral/biomedica/Jmol/jmol/topico-40.html >. Acesso em: 12 mar. 2014. 3- Introdução a Química Orgânica. Disponível em: < http://pt.scribd.com/doc/72822849/30/Hibridacao-do-Oxigenio#>. Acesso em: 12 mar. 2014.









![o Hibridização do Oxigênio
No oxigénio (configuração electrónica 2s22p4), duas das quatro orbitais de valência
estão ocupadas com pares de elétrons não partilhados (que podem participar em
ligações covalente dativas) e as duas restantes estabelecem ligações covalentes
«normais».
A molécula de H2O é uma molécula que apresenta geometria angular e em que o
oxigénio estabelece duas ligações equivalentes com os átomos de
hidrogénio. Recorrendo à Teoria de Orbitais Moleculares para descrever esta molécula
obtêm-se orbitais moleculares obtidas por combinação linear de todas as orbitais
atómicas dos átomos constituintes, isto é, tal como o carbono no metano e o azoto na
amónia, na água o oxigénio apresenta hibridação sp3 e uma configuração electrónica:
[He] sp3
2sp3
2sp3
1sp3
1.
Duas das orbitais híbridas sp3 correspondem assim a dois pares de electrões não
partilhados e apresentam sobreposição máxima com a orbital 1s de cada um dos
hidrogénios. A água é descrita pelo enlace de valência como apresentando dois pares
de electrões não partilhado e duas ligações σ (localizadas) resultantes da sobreposição
ou enlace topo a topo das orbitais 1s do hidrogénio com as orbitais híbridas sp3 do
oxigénio.](https://image.slidesharecdn.com/hibridizaodeorbitaisatmicos-141104065505-conversion-gate01/85/Hibridizacao-de-orbitais-atomicos-9-320.jpg)

![constituintes, isto é, tal como o carbono no metano, o azoto na amónia
apresenta hibridação sp3 e uma configuração electrónica: [He]sp3
2sp3
1sp3
1sp3
1.
Três das orbitais híbridas sp3 apresentam sobreposição máxima com a orbital
1s de cada um dos hidrogénios e a restante corresponde a um par de elétrons não
partilhado. A amónia é descrita como apresentando um par de elétrons não partilhado
e três ligações σ (localizadas) resultantes da sobreposição ou enlace topo a topo das
orbitais 1s do hidrogénio com as orbitais híbridas sp3 do azoto.
A repulsão entre os elétrons não ligantes e os elétrons de repulsão faz com que o
ângulo de 109° 28’ (109,5°) diminua para 107°. A nova geometria formada é piramidal
e permite a molécula maior estabilidade.
O nitrogênio com hibridação sp3 está presente nos compostos orgânicos
nitrogenados, que são representados pelas aminas primárias, secundárias e terciárias.](https://image.slidesharecdn.com/hibridizaodeorbitaisatmicos-141104065505-conversion-gate01/85/Hibridizacao-de-orbitais-atomicos-11-320.jpg)