Reações Orgânicas
- 1. Reações Orgânicas Prof Carlos Priante AULA 17
- 2. Para que ocorra uma reação química, é necessário que as ligações existentes entre os átomos de uma molécula se rompam e esses átomos se rearranjem, formando novas ligações. Entre substâncias orgânicas envolvem apenas o rompimento e a formação de ligações covalentes. • Estas cisões podem ser: HOMOLÍTICA. HETEROLÍTICA.
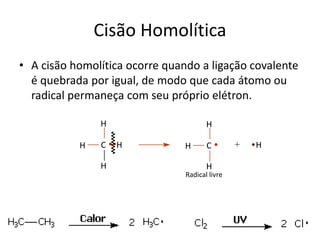
- 3. Cisão Homolítica • A cisão homolítica ocorre quando a ligação covalente é quebrada por igual, de modo que cada átomo ou radical permaneça com seu próprio elétron. H C H H H Radical livre H +C H H H
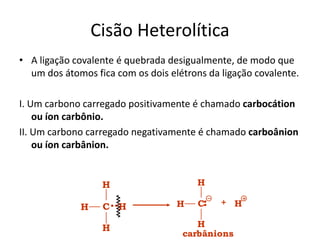
- 4. Cisão Heterolítica • A ligação covalente é quebrada desigualmente, de modo que um dos átomos fica com os dois elétrons da ligação covalente. I. Um carbono carregado positivamente é chamado carbocátion ou íon carbônio. II. Um carbono carregado negativamente é chamado carboânion ou íon carbânion. + H H H C H carbânions H C H H H
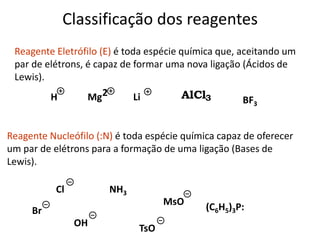
- 5. Classificação dos reagentes Reagente Eletrófilo (E) é toda espécie química que, aceitando um par de elétrons, é capaz de formar uma nova ligação (Ácidos de Lewis). Reagente Nucleófilo (:N) é toda espécie química capaz de oferecer um par de elétrons para a formação de uma ligação (Bases de Lewis). H Mg2 Li BF3 AlCl3 NH3 TsO Br Cl MsO (C6H5)3P: OH
- 6. Tipos de Reações • Reações de substituição • Reações de adição • Reações de eliminação • Reações de oxidação e redução • Reações de esterificação • Reações de Saponificação
- 7. REAÇÕES DE SUBSTITUIÇÃO • Ocorre quando um átomo ou grupo de átomos é substituído por um radical do outro reagente. • É mais comum entre os alcanos, o benzeno e seus derivados, os haletos, álcoois e ácidos carboxílicos. H 3 C C H 2 B r NaOH+ H 3 C C H 2 O H + NaBr
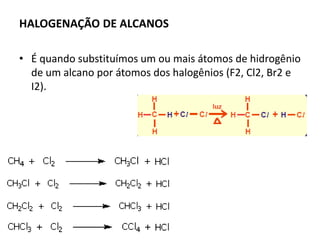
- 8. HALOGENAÇÃO DE ALCANOS • É quando substituímos um ou mais átomos de hidrogênio de um alcano por átomos dos halogênios (F2, Cl2, Br2 e I2).
- 9. • O Hidrogênio que será mais facilmente substituído é o ligado a um carbono terciário. • E o mais difícil de ser substituído é o ligado ao CH4.
- 10. Ex 1. Faça a monobromação do etano. 2. Faça a monocloração do metil-butano
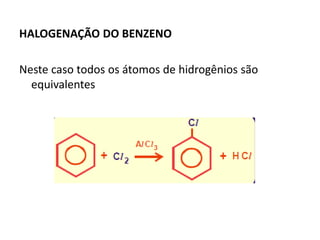
- 11. HALOGENAÇÃO DO BENZENO Neste caso todos os átomos de hidrogênios são equivalentes
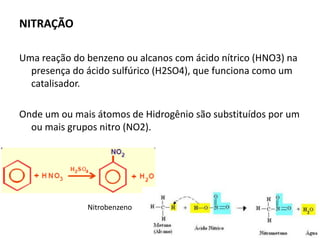
- 12. NITRAÇÃO Uma reação do benzeno ou alcanos com ácido nítrico (HNO3) na presença do ácido sulfúrico (H2SO4), que funciona como um catalisador. Onde um ou mais átomos de Hidrogênio são substituídos por um ou mais grupos nitro (NO2). Nitrobenzeno
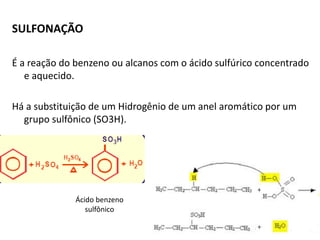
- 13. SULFONAÇÃO É a reação do benzeno ou alcanos com o ácido sulfúrico concentrado e aquecido. Há a substituição de um Hidrogênio de um anel aromático por um grupo sulfônico (SO3H). Ácido benzeno sulfônico
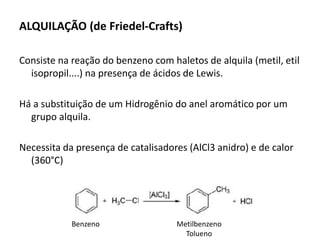
- 14. ALQUILAÇÃO (de Friedel-Crafts) Consiste na reação do benzeno com haletos de alquila (metil, etil isopropil....) na presença de ácidos de Lewis. Há a substituição de um Hidrogênio do anel aromático por um grupo alquila. Necessita da presença de catalisadores (AlCl3 anidro) e de calor (360°C) Metilbenzeno Tolueno Benzeno
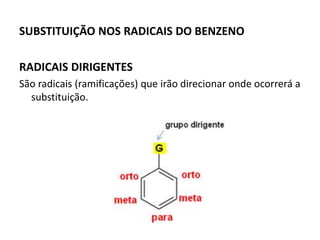
- 15. SUBSTITUIÇÃO NOS RADICAIS DO BENZENO RADICAIS DIRIGENTES São radicais (ramificações) que irão direcionar onde ocorrerá a substituição.
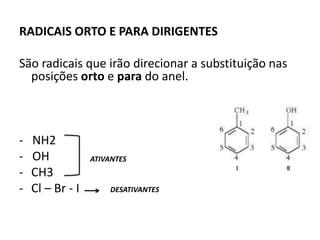
- 16. RADICAIS ORTO E PARA DIRIGENTES São radicais que irão direcionar a substituição nas posições orto e para do anel. - NH2 - OH - CH3 - Cl – Br - I ATIVANTES DESATIVANTES
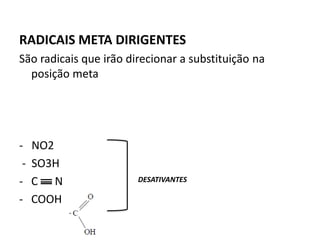
- 18. RADICAIS META DIRIGENTES São radicais que irão direcionar a substituição na posição meta - NO2 - SO3H - C N - COOH DESATIVANTES
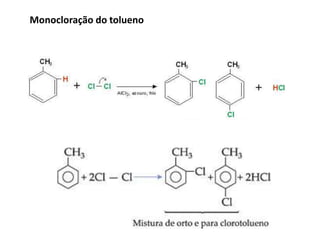
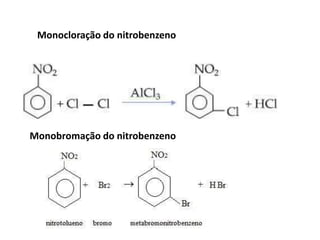
- 19. Monocloração do nitrobenzeno Monobromação do nitrobenzeno
- 20. REAÇÃO DE ADIÇÃO • As reações de adição ocorrem quando se quebra as ligações dos compostos e adiciona- se outras espécies químicas. • Ocorrem principalmente em aldeídos, cetonas, compostos insaturados (alcenos, alcinos, alcadienos), aromáticos e compostos cíclicos.
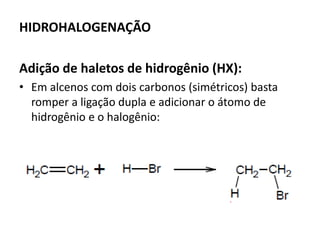
- 21. HIDROHALOGENAÇÃO Adição de haletos de hidrogênio (HX): • Em alcenos com dois carbonos (simétricos) basta romper a ligação dupla e adicionar o átomo de hidrogênio e o halogênio:
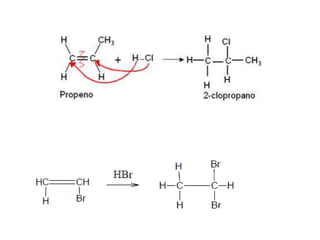
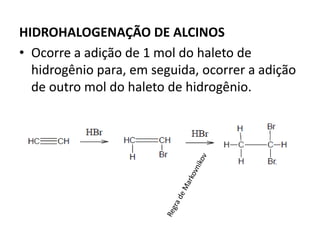
- 22. • Para alcenos com três ou mais átomos de carbono a adição do haleto produzirá dois compostos, • Sendo um deles em maior proporção (produto principal). • Neste caso, devemos levar em consideração a REGRA DE MARKOVNIKOV “O hidrogênio (H+) é adicionado ao carbono da dupla ligação mais hidrogenado”.
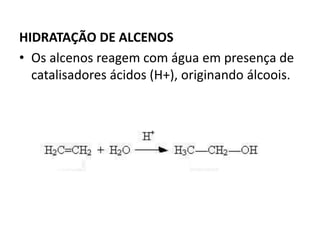
- 24. HIDRATAÇÃO DE ALCENOS • Os alcenos reagem com água em presença de catalisadores ácidos (H+), originando álcoois.
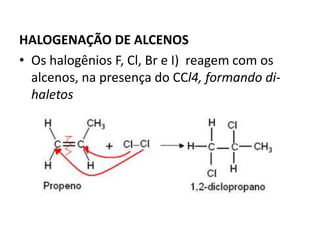
- 25. HALOGENAÇÃO DE ALCENOS • Os halogênios F, Cl, Br e I) reagem com os alcenos, na presença do CCl4, formando di- haletos
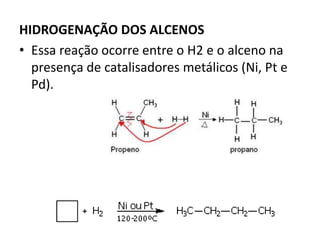
- 26. HIDROGENAÇÃO DOS ALCENOS • Essa reação ocorre entre o H2 e o alceno na presença de catalisadores metálicos (Ni, Pt e Pd).
- 27. HIDROHALOGENAÇÃO DE ALCINOS • Ocorre a adição de 1 mol do haleto de hidrogênio para, em seguida, ocorrer a adição de outro mol do haleto de hidrogênio.
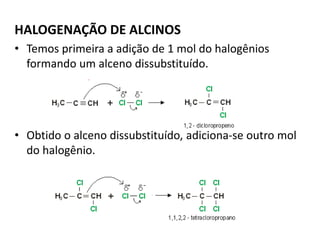
- 28. HALOGENAÇÃO DE ALCINOS • Temos primeira a adição de 1 mol do halogênios formando um alceno dissubstituído. • Obtido o alceno dissubstituído, adiciona-se outro mol do halogênio.
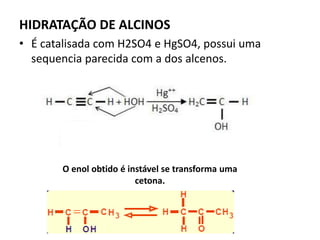
- 29. HIDRATAÇÃO DE ALCINOS • É catalisada com H2SO4 e HgSO4, possui uma sequencia parecida com a dos alcenos. O enol obtido é instável se transforma uma cetona.
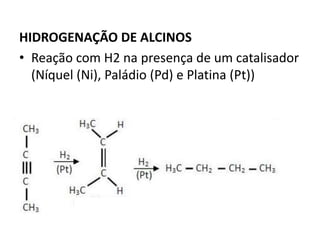
- 30. HIDROGENAÇÃO DE ALCINOS • Reação com H2 na presença de um catalisador (Níquel (Ni), Paládio (Pd) e Platina (Pt))
- 32. REAÇÃO DE ELIMINAÇÃO • São as reações onde alguns átomos ou grupos de átomos são eliminados da molécula orgânica. • Reações inversas as de adição, e importantes na obtenção de alcenos e alcinos.
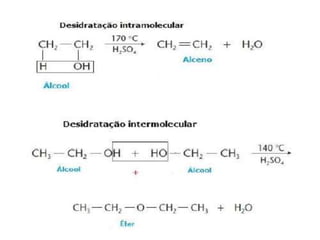
- 33. DESIDRATAÇÃO DE ÁLCOOIS • A desidratação (eliminação de água) de um álcool ocorre com aquecimento deste álcool em presença de ácido sulfúrico. • Regra de SAYTZEFF: elimina-se a oxidrila e o hidrogênio do carbono vizinho ao carbono da oxidrila menos hidrogenado. • Na desidratação forma-se alcenos ou éteres • A ordem de facilidade de desidratação é: terciário > secundário > primário
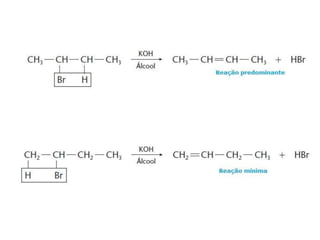
- 35. DESIDRO-HALOGENAÇÃO • Seguem a regra de Saytzef: carbonos menos hidrogenados tendem a perder hidrogênio com mais facilidade. • Esta reação, normalmente, ocorre em solução concentrada de KOH em álcool. • O haleto eliminado reage com o KOH produzindo sal e água.
- 37. DE-HALOGENAÇÃO • Halogênios são eletronegativos, por isso, sua eliminação é facilitada pela ação de eletropositivos. • Ex. ELIMINAÇÃO DE DIBROMETOS: quando tratados com zinco metálicos (Zn+) há eliminação dos dois átomos de bromo, produzindo o alceno e brometo de zinco.
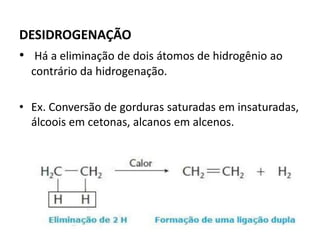
- 38. DESIDROGENAÇÃO • Há a eliminação de dois átomos de hidrogênio ao contrário da hidrogenação. • Ex. Conversão de gorduras saturadas em insaturadas, álcoois em cetonas, alcanos em alcenos.
- 39. REAÇÕES DE OXIDAÇÃO E REDUÇÃO Reações de oxidação • São reações que ocorrem com a entrada de oxigênio na molécula ou saída de hidrogênios; OXIDAÇÃO BRANDA • Nos alcenos: chamada de branda porque só há rompimento de uma ligação da dupla no alceno:
- 40. • Nos alcinos: há o rompimento de duas ligações da tripla ligação; • Se houver hidrogênios ligados aos dois carbonos da tripla ligação, o produto será;
- 41. OZONÓLISE DE ALCENOS • Reação em que o alceno é submetido à ação do ozônio (O₃).
- 42. OXIDAÇÃO DOS ÁLCOOIS • Ocorre na presença como o KMnO₄ ou K₂Cr₂O₇, • em qualquer meio, ou ainda, oxigênio do ar, na presença de cobre e platina (catalisador):
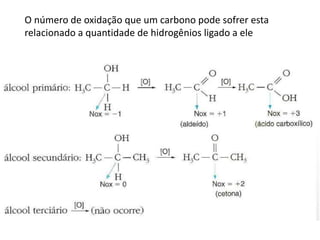
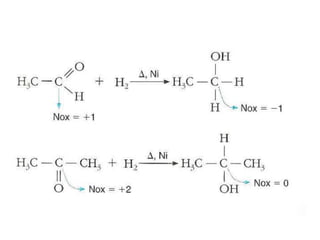
- 43. O número de oxidação que um carbono pode sofrer esta relacionado a quantidade de hidrogênios ligado a ele
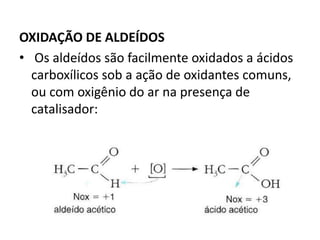
- 44. OXIDAÇÃO DE ALDEÍDOS • Os aldeídos são facilmente oxidados a ácidos carboxílicos sob a ação de oxidantes comuns, ou com oxigênio do ar na presença de catalisador:
- 45. REAÇÕES DE REDUÇÃO • São reações que ocorrem com entrada de hidrogênio na molécula, com saída ou não de oxigênio REDUÇÃO DE ALDEÍDOS E CETONAS • Os aldeídos e as cetonas sofrem redução, originando álcoois primários e secundários, respectivamente; • Essa redução pode ser feita com hidrogênio na presença de Ni ou Pt como catalisador;
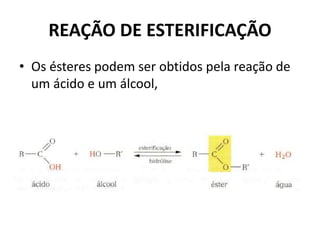
- 47. REAÇÃO DE ESTERIFICAÇÃO • Os ésteres podem ser obtidos pela reação de um ácido e um álcool,
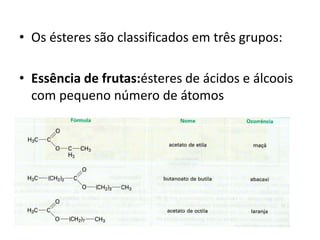
- 48. • Os ésteres são classificados em três grupos: • Essência de frutas:ésteres de ácidos e álcoois com pequeno número de átomos
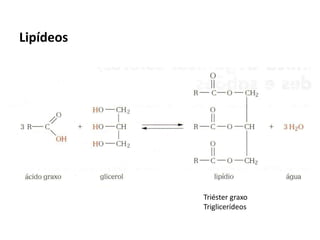
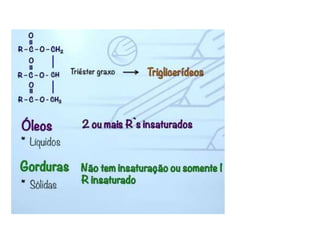
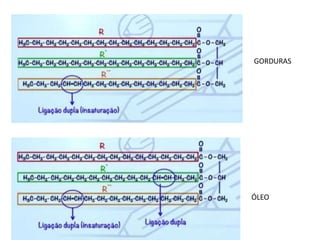
- 51. ÓLEO GORDURAS
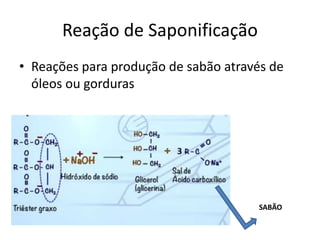
- 52. Reação de Saponificação • Reações para produção de sabão através de óleos ou gorduras SABÃO
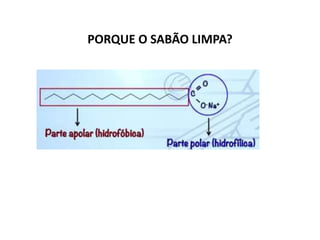
- 53. PORQUE O SABÃO LIMPA?