Ligações Covalenntes
- 1. Ligação covalente ou molecular Ocorre, em geral, entre átomos de não metais onde a diferença de eletronegatividade seja baixa. LIGAÇÕES QUÍMICAS A ligação covalente decorre do compartilhamento de pares de elétrons, com spins opostos ou anti-paralelos, formando moléculas. - se o par de elétrons é constituído por um elétron de cada átomo envolvido, a ligação é dita covalente normal ; - se o par de elétrons é cedido por apenas um dos átomos a ligação é dita covalente dativa ou coordenada .
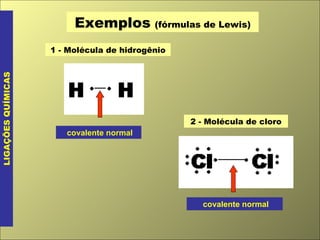
- 2. Exemplos (fórmulas de Lewis) LIGAÇÕES QUÍMICAS 1 - Molécula de hidrogênio covalente normal 2 - Molécula de cloro covalente normal
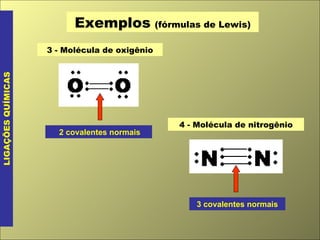
- 3. Exemplos (fórmulas de Lewis) LIGAÇÕES QUÍMICAS 3 - Molécula de oxigênio 2 covalentes normais 4 - Molécula de nitrogênio 3 covalentes normais
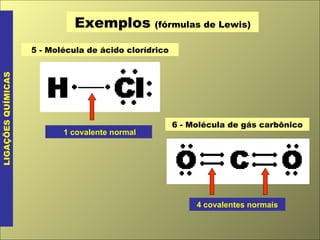
- 4. Exemplos (fórmulas de Lewis) LIGAÇÕES QUÍMICAS 5 - Molécula de ácido clorídrico 1 covalente normal 6 - Molécula de gás carbônico 4 covalentes normais
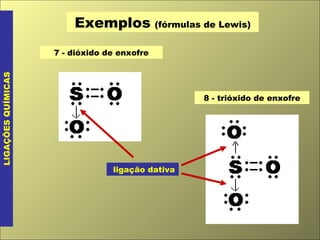
- 5. Exemplos (fórmulas de Lewis) LIGAÇÕES QUÍMICAS 8 - trióxido de enxofre 7 - dióxido de enxofre ligação dativa
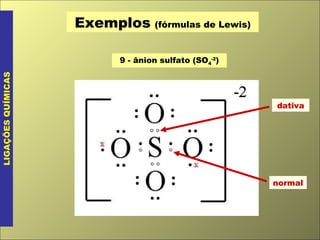
- 6. Exemplos (fórmulas de Lewis) LIGAÇÕES QUÍMICAS 9 - ânion sulfato (SO 4 -2 ) dativa normal
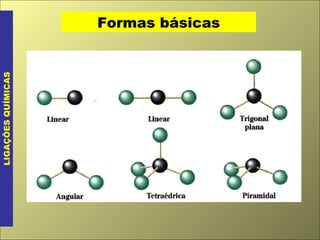
- 7. Geometria molecular LIGAÇÕES QUÍMICAS A orientação espacial das moléculas, em relação aos seus átomos e respectivas ligações chamamos de geometria molecular . A disposição das ligações pode ser explicada por vários modelos teóricos, não contraditórios entre si sendo a de mais fácil compreensão a Teoria da Repulsão dos Pares Eletrônicos da Camada de Valência (TRPECV) proposta por R. Gillespie (1963).
- 8. Geometria molecular LIGAÇÕES QUÍMICAS Segundo a TRPECV: “ ao redor do átomo central, os pares eletrônicos ligantes ou não-ligantes se repelem, tendendo a ficar o mais afastado possível”. pares ligantes = participam das ligações pares não-ligantes = não participam das ligações par eletrônico = ligação simples, dupla, tripla, coordenada ou par não usado (não-ligante).
- 9. Geometria molecular LIGAÇÕES QUÍMICAS Seqüência de passos na aplicação da TRPECV: 1. escreva a fórmula da substância e conte os pares eletrônicos ao redor do átomo central; 2. escolha a disposição geométrica que distribua esses pares de modo a ficarem o mais afastados possível ( usando as formas básicas ) .
- 10. Formas básicas LIGAÇÕES QUÍMICAS
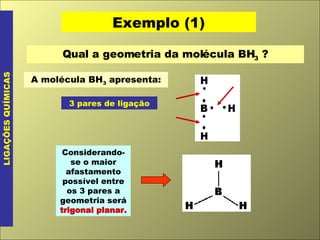
- 11. Exemplo (1) LIGAÇÕES QUÍMICAS Qual a geometria da molécula BH 3 ? A molécula BH 3 apresenta: 3 pares de ligação Considerando-se o maior afastamento possível entre os 3 pares a geometria será trigonal planar.
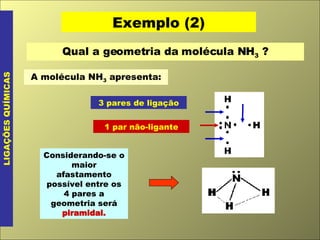
- 12. Exemplo (2) LIGAÇÕES QUÍMICAS Qual a geometria da molécula NH 3 ? A molécula NH 3 apresenta: 3 pares de ligação 1 par não-ligante Considerando-se o maior afastamento possível entre os 4 pares a geometria será piramidal.
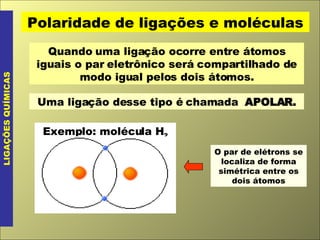
- 13. Polaridade de ligações e moléculas LIGAÇÕES QUÍMICAS Quando uma ligação ocorre entre átomos iguais o par eletrônico será compartilhado de modo igual pelos dois átomos. Uma ligação desse tipo é chamada APOLAR. Exemplo: molécula H 2 O par de elétrons se localiza de forma simétrica entre os dois átomos
- 14. Quando há diferença de eletronegatividade entre os átomos, o par eletrônico da ligação se localiza mais próximo do átomo mais eletronegativo, originando uma ligação chamada POLAR. LIGAÇÕES QUÍMICAS Polaridade de ligações e moléculas O polo negativo estará localizado próximo ao átomo mais eletronegativo e o polo positivo próximo ao átomo mais eletropositivo. Quanto maior for a diferença de eletronegatividade entre os átomos, mais polarizada será a ligação
- 15. Assim, a ligação H - F será mais polarizada do que a ligação H - Cl LIGAÇÕES QUÍMICAS Polaridade de ligações e moléculas + - H F A polarização de uma ligação é simbolizada por um vetor ( ) chamado momento dipolar (μ) cujo módulo é proporcional à diferença de eletronegatividade e cujo sentido é do polo positivo para o negativo .
- 16. LIGAÇÕES QUÍMICAS Polaridade de ligações e moléculas Se a molécula apresenta mais de uma ligação polar a polaridade da molécula será obtida a partir da disposição espacial das ligações polares existentes, com base na geometria molecular e somatório dos vetores momentos dipolares das ligações. * moléculas simétricas APOLARES (R = 0) * moléculas assimétricas POLARES (R 0)
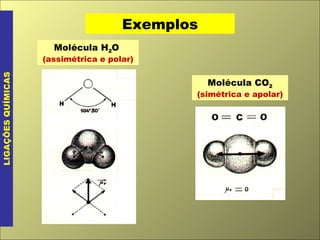
- 17. Molécula H 2 O (assimétrica e polar) LIGAÇÕES QUÍMICAS Exemplos Molécula CO 2 (simétrica e apolar)