Ligaçoes quimicas
- 1. LIGAÇÕES QUÍMICAS Arranjos Atômicos Professora Ana Cristina Félix V. Dias
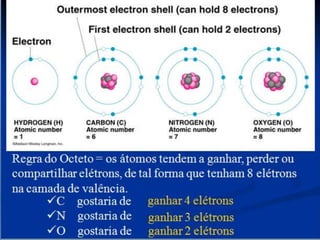
- 2. INTRODUÇÃO As ligações químicas tem forte influência sobre diversas propriedades dos materiais; Os elétrons de valência (do último nível) são os que participam das ligações químicas; Os átomos buscam a configuração mais estável dos gases nobres (com 2 ou 8 elétrons) Dependendo da energia envolvida na ligação elas podem ser divididas em Fortes Fracas
- 4. TIPOS DE LIGAÇÕES Ligações fortes (intramoleculares) Iônicas Covalentes Metálicas Ligações fracas (intermoleculares) Van der waals Ligações dipolo-dipolo Pontes de hidrogênio
- 5. REPRESENTAÇÃO ESQUEMÁTICA DOS ESTADOS DE ENERGIA PREENCHIDOS PARA UM ÁTOMO DE SÓDIO
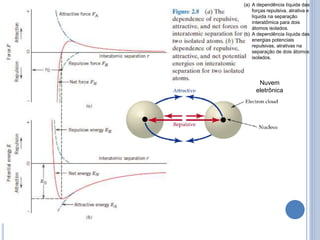
- 8. Nuvem eletrônica (a) A dependência líquida das forças repulsiva, atrativa e líquida na separação interatômica para dois átomos isolados. (b) A dependência líquida das energias potenciais repulsivas, atrativas na separação de dois átomos isolados.
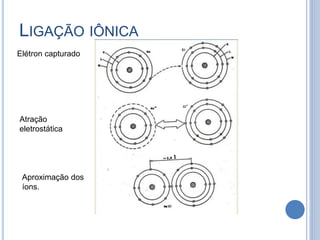
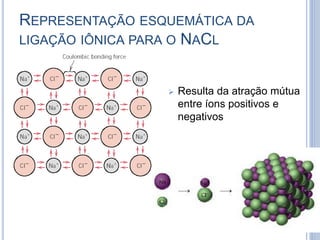
- 10. REPRESENTAÇÃO ESQUEMÁTICA DA LIGAÇÃO IÔNICA PARA O NΑCL Resulta da atração mútua entre íons positivos e negativos
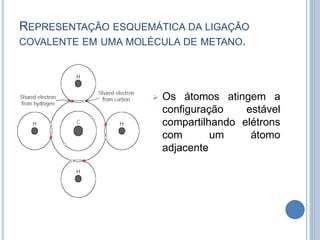
- 11. REPRESENTAÇÃO ESQUEMÁTICA DA LIGAÇÃO COVALENTE EM UMA MOLÉCULA DE METANO. Os átomos atingem a configuração estável compartilhando elétrons com um átomo adjacente
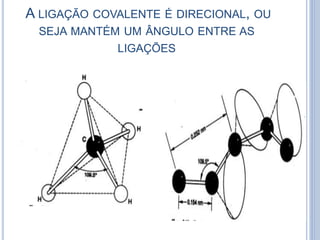
- 12. A LIGAÇÃO COVALENTE É DIRECIONAL, OU SEJA MANTÉM UM ÂNGULO ENTRE AS LIGAÇÕES
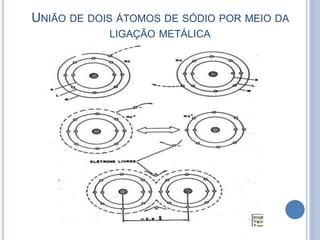
- 13. UNIÃO DE DOIS ÁTOMOS DE SÓDIO POR MEIO DA LIGAÇÃO METÁLICA
- 14. ILUSTRAÇÃO ESQUEMÁTICA DA LIGAÇÃO METÁLICA Estrutura formada por íons positivos e elétrons livres de valência que formam uma “nuvem eletrônica” que circula livremente entre os íons positivos
- 15. PROPRIEDADES ASSOCIADAS AS LIGAÇÕES METÁLICAS Alta condutividade elétrica e térmica: os elétrons podem se mover em presença de uma f.e.m. (força eletromagnética) ou de um gradiente de temperatura. Permitem grande deformação plástica pois as ligações são móveis ou seja não são rígidas como as iônicas e as covalentes. Possuem o brilho metálico, como os elétrons são muito móveis trocam de nível energético com facilidade emitindo fótons. São sempre opacos: pela mesma razão acima mas nesse caso absorvendo a luz incidente.
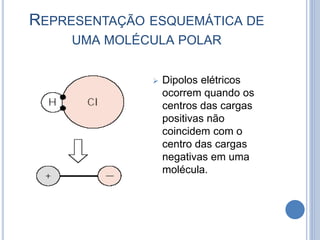
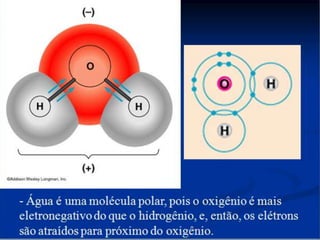
- 16. REPRESENTAÇÃO ESQUEMÁTICA DE UMA MOLÉCULA POLAR Dipolos elétricos ocorrem quando os centros das cargas positivas não coincidem com o centro das cargas negativas em uma molécula.
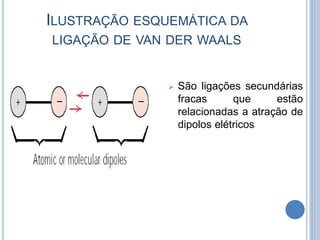
- 17. ILUSTRAÇÃO ESQUEMÁTICA DA LIGAÇÃO DE VAN DER WAALS São ligações secundárias fracas que estão relacionadas a atração de dipolos elétricos
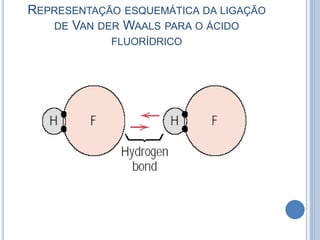
- 18. REPRESENTAÇÃO ESQUEMÁTICA DA LIGAÇÃO DE VAN DER WAALS PARA O ÁCIDO FLUORÍDRICO
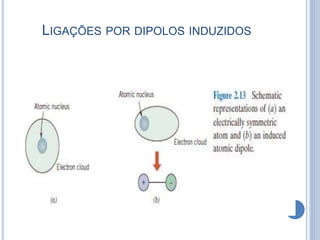
- 19. LIGAÇÕES POR DIPOLOS INDUZIDOS
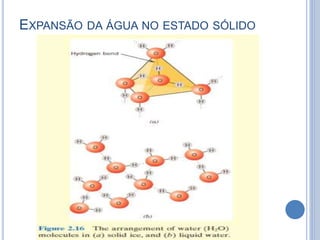
- 21. EXPANSÃO DA ÁGUA NO ESTADO SÓLIDO
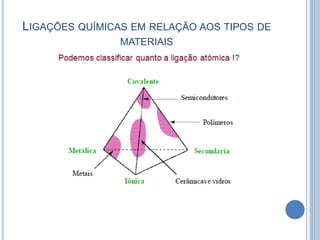
- 22. LIGAÇÕES QUÍMICAS EM RELAÇÃO AOS TIPOS DE MATERIAIS
- 23. INFLUÊNCIA DA ENERGIA DA LIGAÇÃO EM ALGUMAS PROPRIEDADES DOS MATERIAIS Quanto maior a energia envolvida na ligação química há uma tendência de: Maior ser o ponto de fusão do composto; Maior a resistência mecânica; Maior a dureza; Maior o módulo de elasticidade; Maior a estabilidade química; Menor a dilatação térmica.
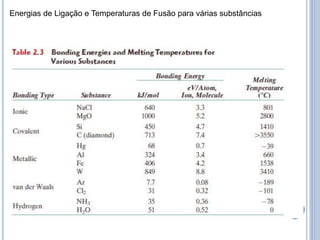
- 24. Energias de Ligação e Temperaturas de Fusão para várias substâncias
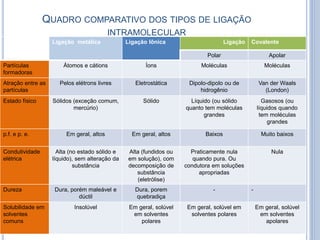
- 26. QUADRO COMPARATIVO DOS TIPOS DE LIGAÇÃO INTRAMOLECULAR Ligação metálica Ligação Iônica Ligação Covalente Polar Apolar Partículas formadoras Átomos e cátions Íons Moléculas Moléculas Atração entre as partículas Pelos elétrons livres Eletrostática Dipolo-dipolo ou de hidrogênio Van der Waals (London) Estado físico Sólidos (exceção comum, mercúrio) Sólido Líquido (ou sólido quanto tem moléculas grandes Gasosos (ou líquidos quando tem moléculas grandes p.f. e p. e. Em geral, altos Em geral, altos Baixos Muito baixos Condutividade elétrica Alta (no estado sólido e líquido), sem alteração da substância Alta (fundidos ou em solução), com decomposição de substância (eletrólise) Praticamente nula quando pura. Ou condutora em soluções apropriadas Nula Dureza Dura, porém maleável e dúctil Dura, porem quebradiça - - Solubilidade em solventes comuns Insolúvel Em geral, solúvel em solventes polares Em geral, solúvel em solventes polares Em geral, solúvel em solventes apolares
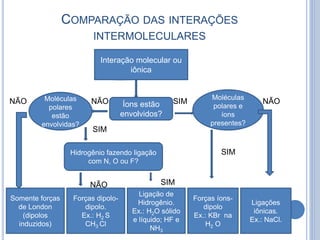
- 27. COMPARAÇÃO DAS INTERAÇÕES INTERMOLECULARES NÃO NÃO SIM NÃO Interação molecular ou iônica Somente forças de London (dipolos induzidos) Ligações iônicas. Ex.: NaCl. Íons estão envolvidos? Hidrogênio fazendo ligação com N, O ou F? Forças dipolo- dipolo. Ex.: H2 S CH3 Cl Ligação de Hidrogênio. Ex.: H2O sólido e líquido; HF e NH3 Forças íons- dipolo Ex.: KBr na H2 O Moléculas polares estão envolvidas? Moléculas polares e íons presentes? SIM SIM SIMNÃO