Estequiometria
- 1. FFóórmula Qurmula Quíímicamica “A idéia de fórmula química surgiu como uma forma de expressar as quantidades das substâncias elementares que se combinam”. Uma fórmula química é uma representação de um composto químico, pode fornecer algumas informações sobre a substância que ela representa. Na formula química aparecem letras e números. Letras representam os elementos químicos que se unem para formar as substâncias. Números subscritos indicam a quantidade de átomos do elemento presente em cada molécula (o número 1 é omitido). Existem três formas de expressar a fórmula química de um dado composto: Fórmula molecular (para os compostos moleculares) Fórmula mínima (para os compostos iônicos) Fórmula Percentual (para ambos) Joel FernandoJoel Fernando
- 2. Conceitos FundamentaisConceitos Fundamentais Número atômico (Z) = número de prótons presentes no núcleo Numero de massa (A) = é a somatória do numero de prótons e nêutrons (N) presentes no núcleo. A = Z + N Isótonos – Átomos que apresentam o mesmo número de nêutrons (N) Isóbaros – Átomos que apresentam o mesmo número de massa (A) Isótopos – São átomos do mesmo elemento (isto é, com os mesmos números de prótons), mas com diferentes números de nêutrons. Assim, têm diferentes números de massa. 12C6 e 13C6 (C, Z= 6) Z A X Joel FernandoJoel Fernando
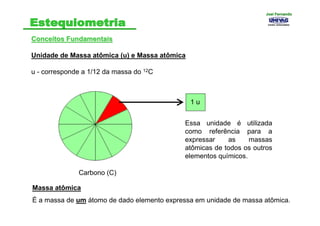
- 3. Conceitos FundamentaisConceitos Fundamentais Unidade de Massa atômica (u) e Massa atômica u - corresponde a 1/12 da massa do 12C Carbono (C) 1 u Essa unidade é utilizada como referência para a expressar as massas atômicas de todos os outros elementos químicos. Massa atômica É a massa de um átomo de dado elemento expressa em unidade de massa atômica. Joel FernandoJoel Fernando
- 4. Conceitos FundamentaisConceitos Fundamentais Massa atômica de um Elemento A massa atômica de um elemento é dada pela média ponderada de seus isótopos naturais. Cálculo da massa atômica do Carbono 12C 98,93% (massa atômica = 12,0000u) 13C 1,07% (massa atômica = 13,0036u) Método (Divide-se a abundância do isótopo por 100 e multiplica como peso) 12C x abundância + 13C x abundância = 100 100 12C x 98,93 + 13C x 1,07 = 100 100 (12,0000u x 0,9893) + (13,00036u x 0,0107) = 12,0107 u Joel FernandoJoel Fernando
- 5. Conceitos FundamentaisConceitos Fundamentais Massa atômica de um Elemento A massa atômica de um elemento é dada pela média ponderada de seus isótopos naturais. Cálculo da massa atômica do Carbono 12C 98,93% (massa atômica = 12,0000u) 13C 1,07% (massa atômica = 13,0036u) Método 2 (multiplica-se a abundância pela massa do isótopo em seguida, divide-se por 100) (12C x abundância) + (13C x abundância) = 100 (12,0000u x 98,93) + (13,00036u x 1,07) = 100 (1187,16 + 13,913852) = 12,0107u 100 . Joel FernandoJoel Fernando
- 6. Conceitos FundamentaisConceitos Fundamentais Atividade Extra Calcule a massa atômica do Cloro considerando os dados a seguir; 35Cl 75,78% (massa atômica = 34, 968853 u) 37Cl 24,22% (massa atômica = 36, 965903 u) R = 35,4u Utilize os dados a seguir para determinar a massa atômica do elemento magnésio; 24Mg 79,0% (massa atômica = 24,0u) 25Mg, 10,0% (massa atômica = 25,0u) 26Mg, 11,0% (massa atômica = 26,0u) R = 24,3u Atividade – Utilize os dados a seguir para determinar a massa atômica do elemento silício; 28Si 92,20% (massa atômica = 27,977u) 29Si 4,67% (massa atômica = 28,977u) 30Si 3,13% (massa atômica = 29,974u) R = 28,1u Joel FernandoJoel Fernando
- 7. Conceitos FundamentaisConceitos Fundamentais Massa molecular É a massa de uma molécula de determinada substância. Dada pela somatória das massas dos átomo que constituem a molécula. Exemplo: Qual a massa molecular da água? (H = 1 u e O = 16 u) H2O Significa dizer que nesta fórmula, a proporção é 2 (dois) Hidrogênios para 1(um) Oxigênio. Hidrogênio: 2 x 1u = 2u Oxigênio: 1 x 16u = 16u Soma: 18u Como citado anteriormente (slide 1), além de expressar a fórmula química pela formula molecular, existem duas outras formas: Fórmula mínima Fórmula Percentual Massa molecular Joel FernandoJoel Fernando
- 8. Fórmula molecular (para os compostos moleculares) Indica a proporção entre o número de átomos dos elementos constituem uma substância. Essa proporção é expressa pelo conjunto de menores números inteiros. Exemplo: NH3, CH4, C6H12O11, CCl4. Fórmula mínima (para os compostos iônicos) Indica quais e quantos átomos de cada elemento constituem uma molécula de uma determinada substância. Exemplo: NaBr, CaF2, AlCl3, AgCl, MgO. Fórmula Percentual (para ambos) Indica os elementos constituintes da substância em uma relação percentual. Exemplo: C40%H6,7%O53,3% (C6H12O6), Ca71,48%O28,52%(CaO) Joel FernandoJoel Fernando
- 9. Atividade Extra Calcule a massa molecular para os compostos moleculares a seguir NH3 R = 17u CH4 R = 16u C6H12O11 R = 260u CCl4 R = 154u De a massa para os compostos iônicos a seguir: NaBr R = 103u CaF2 R = 78,1u AlCl3 R = 133,5u AgCl R = 143,3u MgO R = 40,3u Expresse a fórmula percentual das substâncias a seguir: CH4 R = C75%H25% CHCl3 R = C10,05%H0,83%Cl89,12% CO2 R = C27,27%O72,73% HNO3 R = H1,59%N22,22%O76,19% Joel FernandoJoel Fernando
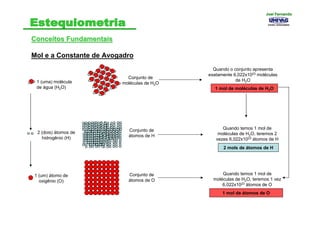
- 10. Conceitos FundamentaisConceitos Fundamentais Mol e a Constante de Avogadro Mol - é a quantidade de matéria de um sistema que contém um número de partículas elementares dado pela constante de Avogadro (6,0221367x1023 partículas) Igual ao número de átomos contido em 12 g de 12C. Então, cada mol de 12C tem 12g de átomos de carbono. Um mol de qualquer substância sempre contém o mesmo número de partículas (átomos, moléculas, íons ou elétrons) 1 (um) átomo de C Conjunto de átomos de C 1 mol de átomos de C Quando o conjunto apresenta exatamente 6,022x1023 átomos de Carbono 1 (uma) molécula de água (H2O) Conjunto de moléculas de H2O 1 mol de moléculas de H2O Quando o conjunto apresenta exatamente 6,022x1023 moléculas de H2O Joel FernandoJoel Fernando
- 11. Conceitos FundamentaisConceitos Fundamentais Mol e a Constante de Avogadro 1 (uma) molécula de água (H2O) Conjunto de moléculas de H2O 1 mol de moléculas de H2O Quando o conjunto apresenta exatamente 6,022x1023 moléculas de H2O 2 (dois) átomos de hidrogênio (H) 1 (um) átomo de oxigênio (O) Conjunto de átomos de H Conjunto de átomos de O 2 mols de átomos de H 1 mol de átomos de O Quando temos 1 mol de moléculas de H2O, teremos 2 vezes 6,022x1023 átomos de H Quando temos 1 mol de moléculas de H2O, teremos 1 vez 6,022x1023 átomos de O Joel FernandoJoel Fernando
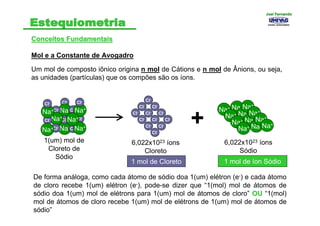
- 12. Conceitos FundamentaisConceitos Fundamentais Mol e a Constante de Avogadro Um mol de composto iônico origina n mol de Cátions e n mol de Ânions, ou seja, as unidades (partículas) que os compões são os íons. Cl- Cl- Na+ Na+ Cl- Cl- Na+ Cl- Cl- Na+ Cl- Na+ Cl- Cl- Cl- Na+ Cl- Na+ Na+ Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ 1(um) mol de Cloreto de Sódio 6,022x1023 íons Cloreto 6,022x1023 íons Sódio 1 mol de Cloreto + 1 mol de íon Sódio De forma análoga, como cada átomo de sódio doa 1(um) elétron (e-) e cada átomo de cloro recebe 1(um) elétron (e-), pode-se dizer que “1(mol) mol de átomos de sódio doa 1(um) mol de elétrons para 1(um) mol de átomos de cloro” OUOU “1(mol) mol de átomos de cloro recebe 1(um) mol de elétrons de 1(um) mol de átomos de sódio” Joel FernandoJoel Fernando
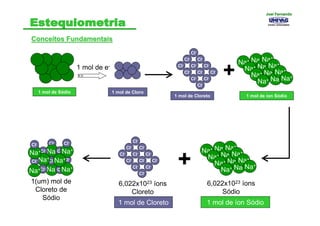
- 13. Conceitos FundamentaisConceitos Fundamentais 1 mol de Sódio 1 mol de Cloro 1 mol de e- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- 1 mol de Cloreto Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ 1 mol de íon Sódio + Cl- Cl- Na+ Na+ Cl- Cl- Na+ Cl- Cl- Na+ Cl- Na+ Cl- Cl- Cl- Na+ Cl- Na+ Na+ Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Cl- Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ Na+ 1(um) mol de Cloreto de Sódio 6,022x1023 íons Cloreto 6,022x1023 íons Sódio 1 mol de Cloreto + 1 mol de íon Sódio Joel FernandoJoel Fernando
- 14. Conceitos FundamentaisConceitos Fundamentais Massa Molar (M) É a massa correspondente a um mol de determinada entidade química (átomo, molécula, íon, etc). “g/mol” Como dito anteriormente, em 12g de 12C existe 1 mol de átomos de carbono 12. Então, podemos escrever cada massa atômica ou massa molecular em razão de 1(um) mol. Exemplo: Massa Molar da Água Sendo a massa atômica do hidrogênio equivalente a 1u, 1 mol de átomos de H contém 1g; 1 g/mol ou 1g mol-1 Sendo a massa atômica do oxigênio equivalente a 16u, 1 mol de átomos de O contém 1g; 16 g/mol ou 16g mol-1 Sendo a massa molecular da água equivalente a 18u, 1 mol de molécula de H2O contém 18g; 18 g/mol ou 18g mol-1 Joel FernandoJoel Fernando
- 15. Conceitos FundamentaisConceitos Fundamentais Número de mols (n) Expressa a quantidade de matéria em mol. n= m M O número de mols presentes em 414 g de água equivale a quantos mols? n = 414g 18g mol-1 = 23 mol Qual o número de mols presentes em 414 g de Etanol, sabendo que a fórmula molecular do mesmo é C2H6O? R = 9 mols. Conversão Massa >> Mol Conversão Mol >> Massa n = m m = n x M M Joel FernandoJoel Fernando
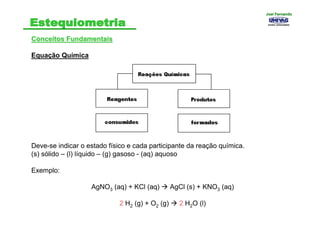
- 16. Conceitos FundamentaisConceitos Fundamentais Equação Química Deve-se indicar o estado físico e cada participante da reação química. (s) sólido – (l) líquido – (g) gasoso - (aq) aquoso Exemplo: AgNO3 (aq) + KCl (aq) AgCl (s) + KNO3 (aq) 2 H2 (g) + O2 (g) 2 H2O (l) Joel FernandoJoel Fernando