Eletroquímica - células eletrolíticas
- 2. A Eletroquímica é a parte da química que estuda o relacionamento entre a corrente elétrica e as reações químicas: - Produção de corrente elétrica, através de uma reação química: pilha- Ocorrência de uma reação química pela passagem da corrente elétrica: eletrólise Para melhor entender a eletroquímica, vamos recordar algo sobre oxidação e redução. Oxidação: Quando uma espécie química perde elétrons na reação.- Redução: quando uma espécie química recebe elétrons na reação. Eletroquímica
- 3. Os elementos envolvidos em uma reação eletroquímica são caracterizados pelo número de elétrons que têm. O número de oxidação de um íon é o número de elétrons que este aceitou ou doou quando comparado com seu estado neutro (que é definido como tendo número de oxidação igual a zero). Se um átomo ou íon doa elétrons em uma reação, seu número de oxidação aumenta, se aceita um elétron seu número diminui.A perda de elétrons de uma substância é chamada oxidação, e o ganho é conhecido como redução. História
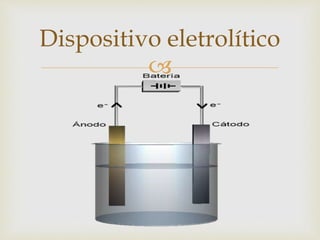
- 4. Ânodo: elétrodo para onde se dirigem os ânions ou, alternativamente, onde se formam cátions. Nesse elétrodo sempre ocorre corrosão, com conseqüente perda de massa, e sempre ocorre oxidação dos ânions ou, alternativamente a formação dos cátions a partir do metal do elétrodo (quando então tem-se também uma oxidação). Cátodo: elétrodo para onde se dirigem os cátions. Nesse elétrodo ocorre sempre depósito, e também redução dos cátions. Elétrodos
- 5. Em pilhas eletroquímicas; Na eletrônica, na produção de placas eletrônicas; Na metalurgia, com a produção de alumínio, de cobre, entre outros; Na produção de commodities industriais, como o hidróxido de sódio; Na operação das células solares; Na biologia, na produção de inúmeras enzimas. Na geologia, com alguns tipos de movimentação na Terra, com a integração das substâncias com polos positivos e negativos. Na usinagem, com a operação de erosão eletroquímica. Aplicações
- 7. Se denomina célula eletrolítica o dispositivo usado para a decomposição mediante a corrente elétrica de corpos ionizados denominados eletrólitos, ou seja, transforma energia elétrica em energia química. Os eletrólitos podem ser ácidos, bases ou sais. O processo de dissociação ou decomposição realizado na célula eletrolítica ´é chamado de eletrólise. Célula eletrolítica
- 8. Ionização - É a fase antes da aplicação da corrente elétrica. Para a eletrólise é necessário que o material esteja na forma de íons, obtendo-se isto por dissolução ou fusão do material. Orientação – Nesta fase, uma vez aplicada a corrente os íons se dirigem, segundo suas cargas elétricas, até os pólos positivos ( + ) e negativos ( - ) correspondentes. Descarga – Os ions negativos ou ânions cedem elétrons ao anodo ( + ) e os ions positivos ou cations tomam elétrons do catodo ( - ). Eletrólise
- 10. Mecanismos Pólos da pilha Pólo positivo – o de menor potencial de oxidação – Cu. Pólo negativo – o de maior potencial de oxidação – Zn. Cátodo e Ânodo Cátodo – placa de menor potencial de oxidação – Cu. Onde ocorre redução. Ânodo – placa de maior potencial de oxidação – Zn. Onde ocorre oxidação. Variação de massa nas placas Placa de maior potencial de oxidação – diminui – Zn. Placa de menor potencial de oxidação – aumenta – Cu.
- 11. Reações químicas da pilha de Volta e de Daniell. Sendo catodo o eletrodo positivo, e sendo o eletrodo onde ocorre a redução, ocorre ganho de elétrons. O anodo sendo o eletrodo negativo, é o eletrodo onde ocorre oxidação, ocorrendo perda de elétrons. Equação global da pilha Zn(s) + Cu(aq) +2 → Zn(aq) +2 + Cu Mecanismos
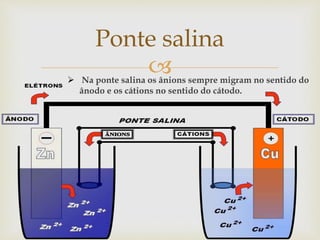
- 12. A pilha de Daniell é representada pela seguinte notação: Zn°/Zn2+//Cu2+/Cu° Ânodo - Ponte Salina ( // ) - Cátodo Pilha de Volta e de Daniell
- 13. A parede porosa (de porcelana, por exemplo) tem por função manter constante a concentração de íons positivos e negativos, durante o funcionamento da pilha. Ela permite a passagem de cátions em excesso em direção ao cátodo e também a passagem dos ânions em direção ao ânodo. Atravessando a parede porosa, os íons em constante migração estabelecem o circuito interno da pilha. Ponte salina
- 14. Ponte salina Na ponte salina os ânions sempre migram no sentido do ânodo e os cátions no sentido do cátodo.
- 15. No ânodo (-) ocorre oxidação: perda de elétrons (aumento de Nox). Ânodo (-) o eletrodo é o redutor: perde elétrons e se oxida. No cátodo (+) ocorre redução: ganho de elétrons (diminuição de Nox). Cátodo (+) o cátion da solução é o oxidante: ganha elétrons e se reduz Para uma pilha qualquer
- 16. Os elétrons fluem do ânodo para o cátodo. Uma pilha genérica pode ser representada por: A0 / A+x // B+y/B0 Oxidação // Redução Para uma pilha qualquer
- 17. Na pilha de Daniell é o eletrodo de zinco que se oxida e o cobre sobre redução. O zinco tem maior tendência em sofrer oxidação. E o eletrodo de cobre tem maior tendência em sofrer redução. Potencial das pilhas
- 18. Esta tendência em se reduzir pode ser medida pelo potencial de redução. O cobre tem maior potencial de redução que o zinco. Logo, o zinco tem menor potencial de redução que o cobre. Potencial das pilhas
- 19. Se uma substância X tem maior potencial de redução que uma substância Y. Então quando X e Y estiverem juntas, X irá se reduzir e Y se oxidar. Potencial de reducao
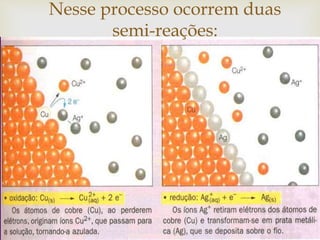
- 20. Nesse processo ocorrem duas semi-reações:
- 21. Maior potencial de reducao: catodo, sofrera reducao. Menor potencial de reducao: anodo, sofrera oxidacao. Ânodo e Cátodo
- 22. O fluxo de eletrons do anodo para o catodo e espontaneo. Os eletrons fluem do anodo para o catodo porque o anodo tem uma energia potencial eletrica mais alta do que o catodo. A diferenca no potencial eletrico e medida em volts. Fluxo de elétrons
- 23. Um volt e a diferenca de potencial necessaria para conceder um joule de energia para uma carga de um coulomb: V = J/C A forca eletromotriz (fem) e a forca necessaria para movimentar os eletrons atraves do circuito externo. Forca eletromotriz
- 24.
- 25. Na pilha de Daniell o Zn tende a se oxidar pois apresente menor Potencia de redução ( - 0,76 V). Enquanto cobre apresenta maior Potencial de redução ( + 0,34 V). DE0 = (E0red maior ) – (E0red menor ) DE0 = 0,34 - (-0,76) DE0 = 0,34 + 0,76 DE0 = 1,10 V Calculando o potencial da pilha de Daniell
- 26. Zn(s) -> Zn (aq) + 2e Cu (aq) + 2e -> Cu(s) Quando DE0 > 0 a reação é espontânea e constitui uma pilha Potencial das pilhas +2 +2
- 27. Verificar se a reação abaixo é espontânea no sentido direto: Obs: Existe uma trabela informando o potencial (V) da semi-redução de recução 3Cu+2 +2 Al0 3Cu0 + 2Al+3 Dados: Cu+2 / Cu0 E0 = 0,34 V Al+3 / Al0 E0 = - 1,68 V Exemplo
- 28. Uso da Tabela de potenciais Quanto mais positivo o E°red, mais forte e o agente oxidante a esquerda. Quanto mais negativo o E°red, mais forte e o agente redutor a direita.
- 29. Pilha comum: pilha de Leclanche
- 30. As pilhas contem alguns metais pesados (mercurio, cadmio) que sao toxicos para os seres vivos. Os metais pesados permanecem no solo, sem se alterarem, durante 50 anos ou mais. O mercurio contamina a agua e o solo e causa doencas no sistema nervoso dos humanos e animais. Pilhas e baterias nao devem ser descartadas no lixo comum. Pilhas comerciais e meio ambiente