Aula-8-Propriedades-Periódicas-2022.3.pdf
- 1. • O átomo consite de entidades neutras, positivas e negativas (prótons, elétrons e nêutrons). • Os prótons e nêutrons estão localizados no núcleo do átomo, que é pequeno. A maior parte da massa do átomo se deve ao núcleo. – Pode haver um número variável de nêutrons para o mesmo número de prótons. Os isótopos têm o mesmo número de prótons, mas números diferentes de nêutrons. • Os elétrons estão localizados fora do núcleo. Grande parte do volume do átomo se deve aos elétrons. A estrutura atômica
- 3. Isótopos, números atômicos e números de massa • Número atômico (Z) = número de prótons no núcleo. • Número de massa (A) = número total de núcleons (prótons + nêutrons). • Por convenção, para um elemento X, escreve-se A ZX. 16 8O: 8 prótons + 8 nêutrons • Encontramos o Z na tabela periódica. A visão moderna da estrutura atômica
- 4. Isótopos, números atômicos e números de massa • Isótopos têm o mesmo Z, porém A é diferente. 16 8O: 8 prótons + 8 nêutrons 17 8O: 8 prótons + 9 nêutrons 18 8O: 8 prótons + 10 nêutrons A visão moderna da estrutura atômica
- 5. Isótopos, números atômicos e números de massa 1 1H: 1 próton 2 1H: 1 próton + 1 nêutron Deutério 3 1H: 1 próton + 2 nêutrons Trítio A visão moderna da estrutura atômica
- 6. A escala de massa atômica • A massa do 12C é 1,992648 x 10-23 g. • Definimos: a massa de 12C = exatamente 12 u. • Usando unidades de massa atômica: 1 u = 1,66054 x 10-24 g 1 g = 6,02214 x 1023 u Pesos atômicos
- 7. Massas atômicas médias • A massa atômica relativa: massas médias dos isótopos: – O C natural: 98,892 % de 12C + 1,107 % de 13C. • A massa média do C: • (0,98892)(12 u) + (0,01107)(13,00335 u) = 12,01 u • A massa atômica é também conhecida como massa atômica média. • As massas atômicas médias estão relacionadas na tabela periódica. Pesos atômicos
- 8. O Enxofre é encontrado como uma mistura isotópica composta por: 95,02% de 32S (massa atômica = 31,972 u) 0,75% de 33S (massa atômica = 32,972 u) 4,21% de 34S (massa atômica = 33,968 u) 0,02% de 36S (massa atômica = 35,967 u) Calcule a massa atômica média do enxofre. Pesos atômicos Massas atômicas médias Abundância Isotrópica
- 9. O Enxofre é encontrado como uma mistura isotópica composta por: 95,02% de 32S (massa atômica = 31,972 u) 0,75% de 33S (massa atômica = 32,972 u) 4,21% de 34S (massa atômica = 33,968 u) 0,02% de 36S (massa atômica = 35,967 u) Calcule a massa atômica média do enxofre: (0,9502 x 31,972) + Pesos atômicos Massas atômicas médias Abundância Isotrópica
- 10. O Enxofre é encontrado como uma mistura isotópica composta por: 95,02% de 32S (massa atômica = 31,972 u) 0,75% de 33S (massa atômica = 32,972 u) 4,21% de 34S (massa atômica = 33,968 u) 0,02% de 36S (massa atômica = 35,967 u) Calcule a massa atômica média do enxofre: (0,9502 x 31,972) + (0,0075 x 32,972) + Pesos atômicos Massas atômicas médias Abundância Isotrópica
- 11. O Enxofre é encontrado como uma mistura isotópica composta por: 95,02% de 32S (massa atômica = 31,972 u) 0,75% de 33S (massa atômica = 32,972 u) 4,21% de 34S (massa atômica = 33,968 u) 0,02% de 36S (massa atômica = 35,967 u) Calcule a massa atômica média do enxofre: (0,9502 x 31,972) + (0,0075 x 32,972) + (0,0421 x 33,968) + Pesos atômicos Massas atômicas médias Abundância Isotrópica
- 12. O Enxofre é encontrado como uma mistura isotópica composta por: 95,02% de 32S (massa atômica = 31,972 u) 0,75% de 33S (massa atômica = 32,972 u) 4,21% de 34S (massa atômica = 33,968 u) 0,02% de 36S (massa atômica = 35,967 u) Calcule a massa atômica média do enxofre: (0,9502 x 31,972) + (0,0075 x 32,972) + (0,0421 x 33,968) + + (0,0002 x 35,967) Pesos atômicos Massas atômicas médias Abundância Isotrópica
- 13. O Enxofre é encontrado como uma mistura isotópica composta por: 95,02% de 32S (massa atômica = 31,972 u) 0,75% de 33S (massa atômica = 32,972 u) 4,21% de 34S (massa atômica = 33,968 u) 0,02% de 36S (massa atômica = 35,967 u) Calcule a massa atômica média do enxofre: (0,9502 x 31,972) + (0,0075 x 32,972) + (0,0421 x 33,968) + + (0,0002 x 35,967) = 32,06 u Pesos atômicos Massas atômicas médias Abundância Isotrópica
- 14. O Enxofre é encontrado como uma mistura isotópica composta por: 95,02% de 32S (massa atômica = 31,972 u) 0,75% de 33S (massa atômica = 32,972 u) 4,21% de 34S (massa atômica = 33,968 u) 0,02% de 36S (massa atômica = 35,967 u) Pesos atômicos Massas atômicas médias Abundância Isotrópica (95,02 x 31,972) + (0,75x32,972) + (4,21x33,968) + (0,02x35,967) 100
- 16. • Em 1800, haviam 31 elementos conhecidos. • Em 1865, haviam 63 elementos conhecidos. • Em 2002, haviam 115 elementos conhecidos. • Em 2022 já são 118 elementos conhecidos • Como organizar 118 elementos diferentes de forma que possamos fazer previsões sobre elementos não descobertos? O desenvolvimento da tabela periódica
- 17. • Ordenar os elementos de modo que reflita as tendências nas propriedades químicas e físicas. • A primeira tentativa (Mendeleev e Meyer) ordenou os elementos em ordem crescente de massa atômica. • Faltavam alguns elementos nesse esquema. Exemplo: em 1871, Mendeleev observou que a posição mais adequada para o As seria abaixo do P, e não do Si, o que deixou um elemento faltando abaixo do Si. Ele previu um número de propriedades para este elemento. Em 1886 o Ge foi descoberto. As propriedades do Ge se equiparam bem à previsão de Mendeleev. O desenvolvimento da tabela periódica
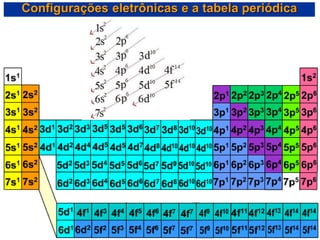
- 19. Configurações eletrônicas e a tabela periódica
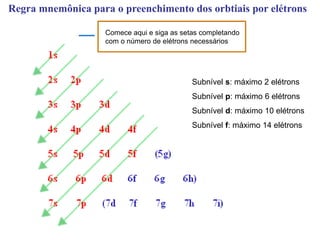
- 20. Regra mnemônica para o preenchimento dos orbtiais por elétrons Comece aqui e siga as setas completando com o número de elétrons necessários Subnível s: máximo 2 elétrons Subnível p: máximo 6 elétrons Subnível d: máximo 10 elétrons Subnível f: máximo 14 elétrons
- 21. Configurações eletrônicas e a tabela periódica
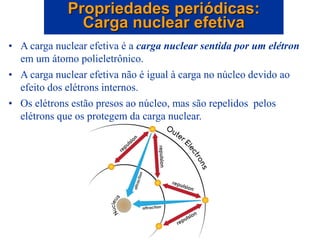
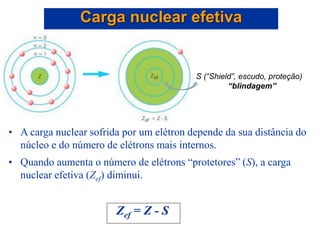
- 22. • A carga nuclear efetiva é a carga nuclear sentida por um elétron em um átomo polieletrônico. • A carga nuclear efetiva não é igual à carga no núcleo devido ao efeito dos elétrons internos. • Os elétrons estão presos ao núcleo, mas são repelidos pelos elétrons que os protegem da carga nuclear. Propriedades periódicas: Carga nuclear efetiva
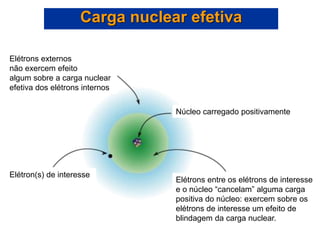
- 23. Carga nuclear efetiva Elétrons externos não exercem efeito algum sobre a carga nuclear efetiva dos elétrons internos Núcleo carregado positivamente Elétron(s) de interesse Elétrons entre os elétrons de interesse e o núcleo “cancelam” alguma carga positiva do núcleo: exercem sobre os elétrons de interesse um efeito de blindagem da carga nuclear.
- 24. • A carga nuclear sofrida por um elétron depende da sua distância do núcleo e do número de elétrons mais internos. • Quando aumenta o número de elétrons “protetores” (S), a carga nuclear efetiva (Zef) diminui. Zef = Z - S Carga nuclear efetiva S (“Shield”, escudo, proteção) “blindagem”
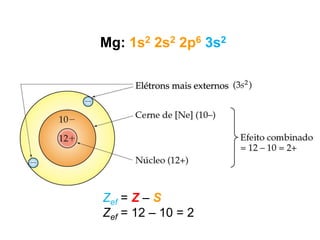
- 25. Mg: 1s2 2s2 2p6 3s2 Zef = Z – S Zef = 12 – 10 = 2
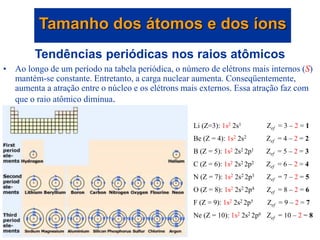
- 26. Carga nuclear efetiva Zef = Z - S Li (Z=3): 1s2 2s1 Zef = 3 – 2 = 1 Be (Z = 4): 1s2 2s2 Zef = 4 – 2 = 2 B (Z = 5): 1s2 2s2 2p1 Zef = 5 – 2 = 3 C (Z = 6): 1s2 2s2 2p2 Zef = 6 – 2 = 4 N (Z = 7): 1s2 2s2 2p3 Zef = 7 – 2 = 5 O (Z = 8): 1s2 2s2 2p4 Zef = 8 – 2 = 6 F (Z = 9): 1s2 2s2 2p5 Zef = 9 – 2 = 7 Ne (Z = 10): 1s2 2s2 2p6 Zef = 10 – 2 = 8
- 27. Carga nuclear efetiva Zef = Z - S N (Z = 7): 1s2 2s2 2p3 Zef = 7 – 2 = 5 P (Z = 15): 1s2 2s2 2p6 3s2 3p3 Zef = 15 – 10 = 5 As (Z = 33): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3 Zef = 33 – 28 = 5 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
- 28. Carga nuclear efetiva Zef = Z - S N (Z = 7): 1s2 2s2 2p3 Zef = 7 – 2 = 5 P (Z = 15): 1s2 2s2 2p6 3s2 3p3 Zef = 15 – 10 = 5 Quem sente a maior carga nuclear efetiva: um elétron na 2ª camada do N ou um elétron na 2ª camada do P? N (Z = 7): 1s2 2s2 2p3 P (Z = 15): 1s2 2s2 2p6 3s2 3p3
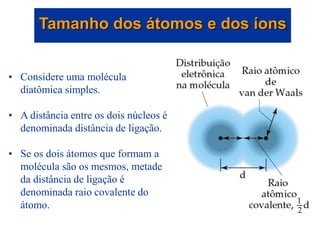
- 29. • Considere uma molécula diatômica simples. • A distância entre os dois núcleos é denominada distância de ligação. • Se os dois átomos que formam a molécula são os mesmos, metade da distância de ligação é denominada raio covalente do átomo. Tamanho dos átomos e dos íons
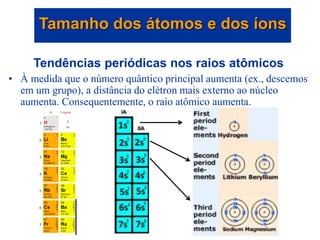
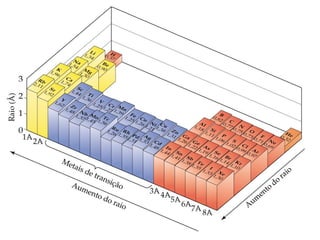
- 30. Tendências periódicas nos raios atômicos • À medida que o número quântico principal aumenta (ex., descemos em um grupo), a distância do elétron mais externo ao núcleo aumenta. Consequentemente, o raio atômico aumenta. Tamanho dos átomos e dos íons
- 31. Tendências periódicas nos raios atômicos • Ao longo de um período na tabela periódica, o número de elétrons mais internos (S) mantém-se constante. Entretanto, a carga nuclear aumenta. Conseqüentemente, aumenta a atração entre o núcleo e os elétrons mais externos. Essa atração faz com que o raio atômico diminua. Tamanho dos átomos e dos íons Li (Z=3): 1s2 2s1 Zef = 3 – 2 = 1 Be (Z = 4): 1s2 2s2 Zef = 4 – 2 = 2 B (Z = 5): 1s2 2s2 2p1 Zef = 5 – 2 = 3 C (Z = 6): 1s2 2s2 2p2 Zef = 6 – 2 = 4 N (Z = 7): 1s2 2s2 2p3 Zef = 7 – 2 = 5 O (Z = 8): 1s2 2s2 2p4 Zef = 8 – 2 = 6 F (Z = 9): 1s2 2s2 2p5 Zef = 9 – 2 = 7 Ne (Z = 10): 1s2 2s2 2p6 Zef = 10 – 2 = 8
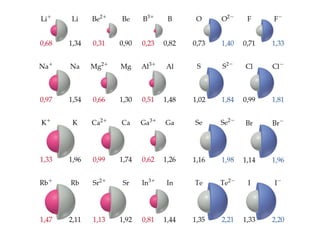
- 33. Tendências nos tamanhos dos íons • O tamanho do íon é a distância entre os íons em um composto iônico. • O tamanho do íon também depende da carga nuclear, do número de elétrons e dos orbitais que contenham os elétrons de valência. • Os cátions deixam vago o orbital mais volumoso e são menores do que os átomos que lhes dão origem. • Os ânions adicionam elétrons ao orbital mais volumoso e são maiores do que os átomos que lhe dão origem. Tamanho dos átomos e dos íons
- 35. Tendências dos tamanhos dos íons • Todos os membros de uma série isoeletrônica têm o mesmo número de elétrons. O (Z = 8): 1s2 2s2 2p4 O2- (Z = 8): 1s2 2s2 2p6 F (Z = 9): 1s2 2s2 2p5 F- (Z = 9): 1s2 2s2 2p6 Na (Z = 11): 1s2 2s2 2p6 3s1 Na+ (Z = 11): 1s2 2s2 2p6 • Quando a carga nuclear (Z) aumenta em uma série isoeletrônica, os íons tornam-se menores : O2- > F- > Na+ > Mg2+ > Al3+ Z = 8 9 11 12 13 Tamanho dos átomos e dos íons +2e- +1e- -1e-
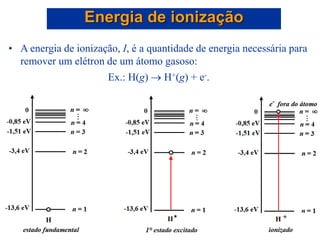
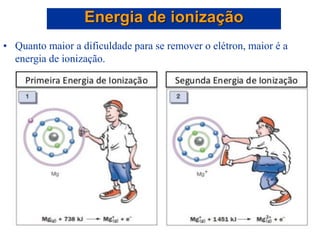
- 36. • A energia de ionização, I, é a quantidade de energia necessária para remover um elétron de um átomo gasoso: Ex.: H(g) H+(g) + e-. Energia de ionização *
- 37. • Quanto maior a dificuldade para se remover o elétron, maior será a energia de ionização. • A primeira energia de ionização, I1, é a quantidade de energia necessária para remover um elétron de um átomo gasoso: Na(g) Na+(g) + e-. • A segunda energia de ionização, I2, é a energia necessária para remover um elétron de um íon gasoso: Na+(g) Na2+(g) + e-. Energia de ionização
- 38. • Quanto maior a dificuldade para se remover o elétron, maior é a energia de ionização. Energia de ionização
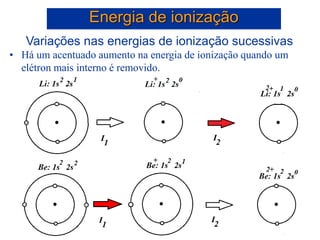
- 39. Variações nas energias de ionização sucessivas • Há um acentuado aumento na energia de ionização quando um elétron mais interno é removido. Energia de ionização
- 40. Variações nas energias de ionização sucessivas • Há um acentuado aumento na energia de ionização quando um elétron mais interno é removido. Energia de ionização
- 41. Variações nas energias de ionização sucessivas • Há um acentuado aumento na energia de ionização quando um elétron mais interno é removido. Energia de ionização
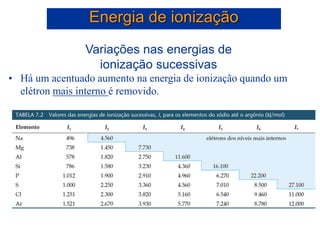
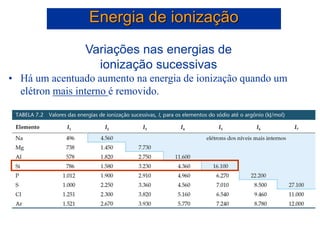
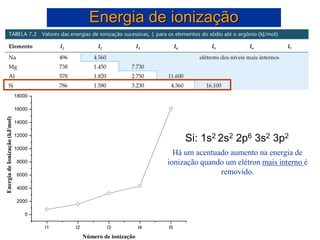
- 42. Energia de ionização I1 I2 I3 I4 I5 0 2000 4000 6000 8000 10000 12000 14000 16000 18000 Energia de Ionização (kJ/mol) Número de ionização Há um acentuado aumento na energia de ionização quando um elétron mais interno é removido. Si: 1s2 2s2 2p6 3s2 3p2
- 43. Variações nas energias de ionização sucessivas • Há um acentuado aumento na energia de ionização quando um elétron mais interno é removido. Energia de ionização Si: 1s2 2s2 2p6 3s2 3p2 Si: 1s2 2s2 2p6 3s2 3p2 Si+: 1s2 2s2 2p6 3s2 3p1 + e- I1 = 787 kJ/mol Si+: 1s2 2s2 2p6 3s2 3p1 Si2+: 1s2 2s2 2p6 3s2 + e- I2 = 1.580 kJ/mol Si2+: 1s2 2s2 2p6 3s2 Si3+: 1s2 2s2 2p6 3s1 + e- I3 = 3.230 kJ/mol Si3+: 1s2 2s2 2p6 3s1 Si4+: 1s2 2s2 2p6 + e- I4 = 4.360 kJ/mol Si4+: 1s2 2s2 2p6 Si5+: 1s2 2s2 2p5 + e- I5 = 16.100 kJ/mol
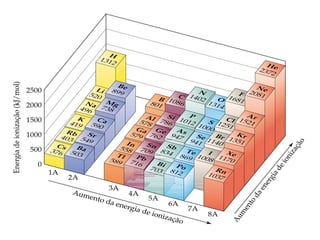
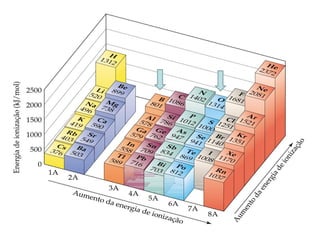
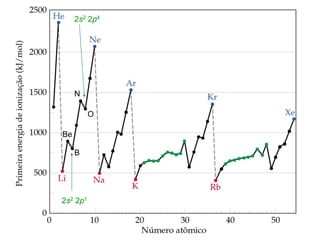
- 44. Tendências periódicas nas primeiras energias de ionização • A energia de ionização diminui à medida que descemos em um grupo. • Isso significa que o elétron mais externo é mais facilmente removido ao descermos em um grupo. • À medida que o átomo aumenta, torna-se mais fácil remover um elétron do orbital mais volumoso. Energia de ionização
- 45. Tendências periódicas nas primeiras energias de ionização • A energia de ionização aumenta ao longo do período. • A carga nuclear efetiva dos elétrons de valência aumenta ao longo do período, consequentemente o tamanho dos átomos diminui. • Os elétrons estão mais fortemente ligados ao núcleo conforme a carga nuclear efetiva aumenta. Energia de ionização
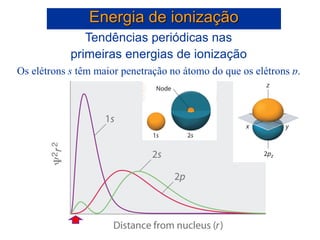
- 49. Tendências periódicas nas primeiras energias de ionização Os elétrons s têm maior penetração no átomo do que os elétrons p. Energia de ionização
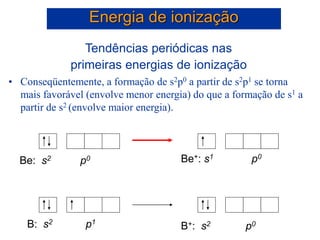
- 50. Tendências periódicas nas primeiras energias de ionização • Conseqüentemente, a formação de s2p0 a partir de s2p1 se torna mais favorável (envolve menor energia) do que a formação de s1 a partir de s2 (envolve maior energia). Energia de ionização B: s2 p1 B+: s2 p0 Be: s2 p0 Be+: s1 p0
- 51. Tendências periódicas nas primeiras energias de ionização • Quando um segundo elétron encontra-se em um orbital p, aumenta a repulsão elétron-elétron, o que torna sua retirada mais fácil. Energia de ionização O: s2 p4 N: s2 p3
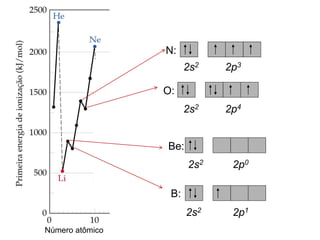
- 52. 2s2 2p0 2s2 2p1 2s2 2p4 2s2 2p3 Número atômico N: O: Be: B:
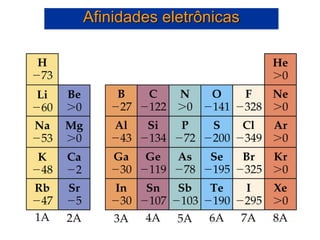
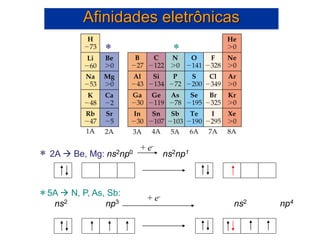
- 53. • A afinidade eletrônica é o oposto da energia de ionização. • A afinidade eletrônica é a alteração de energia quando um átomo gasoso ganha um elétron para formar um íon gasoso • A afinidade eletrônica pode ser tanto exotérmica quanto endotérmica: Cl(g) + e- Cl-(g) E = -349 kJ/mol [Ne]3s23p5 [Ne]3s23p6 Ar(g) + e- Ar-(g) E > 0 [Ne]3s23p6 [Ne]3s23p64s1 Afinidades eletrônicas
- 55. Afinidades eletrônicas 2A Be, Mg: ns2np0 ns2np1 5A N, P, As, Sb: ns2 np3 ns2 np4 + e- + e- * * * *
- 56. Afinidades eletrônicas A 2ª Afinidade eletrônica é sempre positiva: O + e- → O- 1ª A.E. = -141 kJ/mol O- + e- → O2- 2ª A.E. = +844 kJ/mol O elétron deve ser adicionado em um íon negativo, e a repulsão intereletrônica faz com que seja necessário fornecer energia para compensar essa repulsão. O elétron não vai se aproximar de um íon negativo sem uma forcinha



























![• A afinidade eletrônica é o oposto da energia de ionização.
• A afinidade eletrônica é a alteração de energia quando um átomo
gasoso ganha um elétron para formar um íon gasoso
• A afinidade eletrônica pode ser tanto exotérmica quanto endotérmica:
Cl(g) + e- Cl-(g) E = -349 kJ/mol
[Ne]3s23p5 [Ne]3s23p6
Ar(g) + e- Ar-(g) E > 0
[Ne]3s23p6 [Ne]3s23p64s1
Afinidades eletrônicas](https://image.slidesharecdn.com/aula-8-propriedades-peridicas-2022-250423231721-9ae86e22/85/Aula-8-Propriedades-Periodicas-2022-3-pdf-53-320.jpg)