exposicion
- 2. • Son aquellos cambios que no afectan la composición de la materia; en estos cambios físicos no se forman nuevas sustancias. • Simplemente se dan estos cambios cuando ocurren fenómenos como: El aroma del perfume, se esparce por la habitación al abrir el frasco que lo contiene Al añadir azúcar al agua, el azúcar se disuelve totalmente. Los aromas para la casa y baños, que esparcen por todo el lugar dejando una fragancia. • Cada una de estas transformaciones se producen sin que cambie la identidad de las sustancias, solo podrían cambiar sus propiedades físicas es así que se dice que hubo una transformación física.
- 4. Cambios de estado • En física y química se denomina cambio de estado la evolución de la materia entre varios estados de agregación sin que ocurra un cambio en su composición. • Los tres estados más estudiados y comunes en la Tierra son: El sólido El líquido El gaseoso No obstante, el estado de agregación más común en el Universo es el plasma, material del que están compuestas las estrellas (si se descarta la materia oscura).
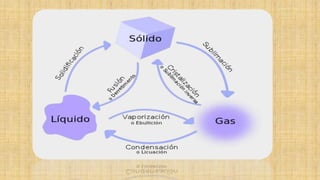
- 5. Cambios de estado de agregación de la materia • Son los procesos en los que un estado de la materia cambia a otro manteniendo una semejanza en su composición. A continuación se describen los diferentes cambios de estado o transformaciones de fase de la materia: • Fusión: Es el paso de un sólido al estado líquido por medio del calor; durante este proceso endotérmico (proceso que absorbe energía para llevarse a cabo este cambio) hay un punto en que la temperatura permanece constante. El "punto de fusión” es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cada sustancia. Cuando dichas moléculas se moverán en una forma independiente, transformándose en un líquido. Un ejemplo podría ser un hielo derritiéndose, pues pasa de estado sólido al líquido. • Solidificación: Es el paso de un líquido a sólido por medio del enfriamiento; el proceso es exotérmico. El "punto de solidificación" o de congelación es la temperatura a la cual el líquido se solidifica y permanece constante durante el cambio, y coincide con el punto de fusión si se realiza de forma lenta (reversible); su valor es también específico.
- 7. • Vaporización y ebullición: Son los procesos físicos en los que un líquido pasa a estado gaseoso. Si se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión continuar calentándose el líquido, éste absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión del agua en estado líquido en agua en estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. En ese momento es posible aumentar la temperatura del gas. • Condensación: Se denomina condensación al cambio de estado de la materia que se pasa de forma gaseosa a forma líquida. Es el proceso inverso a la vaporación. Si se produce un paso de estado gaseoso a estado sólido de manera directa, el proceso es llamado sublimación inversa. Si se produce un paso del estado líquido a sólido se denomina solidificación. • Sublimación: Es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Al proceso inverso se le denomina Sublimación inversa; es decir, el paso directo del estado gaseoso al estado sólido. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco. • Desionización: Es el cambio de un plasma a gas. • Ionización: Es el cambio de un gas a un plasma.
- 8. Punto de ebullición • La definición formal de punto de ebullición es aquella temperatura en la cual la presión de vapor del líquido iguala a la presión de vapor del medio en el que se encuentra.Coloquialmente, se dice que es la temperatura a la cual la materia cambia del estado líquido al estado gaseoso. • La temperatura de una sustancia o cuerpo depende de la energía cinética media de las moléculas. A temperaturas inferiores al punto de ebullición, sólo una pequeña fracción de las moléculas en la superficie tiene energía suficiente para romper la tensión superficial y escapar. Este incremento de energía constituye un intercambio de calor que da lugar al aumento de la entropía del sistema (tendencia al desorden de las partículas que componen su cuerpo).
- 9. • El punto de ebullición depende de la masa molecular de la sustancia y del tipo de las fuerzas intermoleculares de esta sustancia. Para ello se debe determinar si la sustancia es covalente polar, covalente no polar, y determinar el tipo de enlaces (dipolo permanente - dipolo inducido o puentes de hidrógeno). • El punto de ebullición no puede elevarse en forma indefinida. Conforme se aumenta la presión, la densidad de la fase gaseosa aumenta hasta que, finalmente, se vuelve indistinguible de la fase líquida con la que está en equilibrio; ésta es la temperatura crítica, por encima de la cual no existe una fase líquida clara. El helio tiene el punto normal de ebullición más bajo (-268,9 °C) de los correspondientes a cualquier sustancia, y el carburo de tungsteno, uno de los más altos (5555 °C).
- 10. Punto de Fusión Semejanzas: Ambos puntos son puntos con un grado de libertad, esto es que varían sólo con la presión. A presión constante, las temperaturas permanecen fijas hasta que toda la masa de una dada sustancia pasa de un estado a otro. Ambos puntos sufren variaciones si las sustancias son mezclas presentando lo que se llama las propiedades coligativas, estas son el ascenso ebulloscópico y el descenso crioscópico. Punto de Ebullición Diferencias: Ebullición: Una es el punto de pasaje de una sustancia de estado Líquido a gaseoso. Fusión: Es el pasaje de una sustancia de sólido a líquido.
- 11. • Mientras se calienta una sustancia como el agua o el hierro, su temperatura se incrementa. Si suministras calor en una tasa constante a un material aislante y gráficas su temperatura respecto del tiempo, obtendrás una curva de calentamiento. Las curvas de calentamiento revelan un par de cosas interesantes sobre cambios de fase, cuando un material cambia de una fase (por ejemplo solido, liquido, gas) a otra. • Para obtener una curva de calentamiento del agua (o de otro líquido) lo único que hay que hacer es calentar una sustancia (por ejemplo agua) e ir tomando la temperatura cada cierto tiempo (por ejemplo 1 minuto) y la vamos apuntando. Entonces, una curva de calentamiento será el resultado de representar gráficamente los valores de la temperatura que adquiere un cuerpo al aplicarle calor durante un cierto tiempo.