MODULO ESTERILIZACION Y SUMINISTROS UNIDAD III.pdf
- 2. FALLAS EN EL PROCESO DE ESTERILIZACIÓN El evento que falle el proceso de esterilización y para el manejo de los equipos estériles que tengan fecha de vencimiento se deben utilizar las siguientes recomendaciones: • Todos los materiales estériles cuya fecha de expiración ha caducado no son considerados seguros para el uso con los pacientes y deben ser removidos del servicio. • Los objetos que son procesados en el hospital deben volver a la CE. Aquí se deben abrir las cajas, remplazar las toallas de algodón y colocar un nuevo indicador químico en su interior. • Los productos esterilizados por el fabricante no deben ser reesterilizados a menos que la marca comercial provea instrucciones escritas para su reesterilización. Existen normas de reesterilización de materiales de uso médico. • En el evento que un esterilizador falle, revelado por el cambio de color del indicador biológico, debe ser puesto fuera de servicio inmediatamente y se debe notificar al servicio de mantenimiento para su reparación. Todos los objetos que no hayan sido usados de dicha carga deben ser recogidos y reesterilizados. • El personal de Control de Infecciones debe ser notificado de la falla del esterilizador para hacer el seguimiento de los pacientes.
- 3. • El técnico de la C.E. es responsable de los resultados obtenidos de los indicadores biológicos de cada carga, ya sea en las autoclaves de vapor como por óxido de etileno. si el indicador biológico sugiere una falla en el esterilizador, el técnico debe notificar inmediatamente al supervisor del departamento y sacar de servicio el esterilizador. • El supervisor del departamento debe notificar al servicio de mantenimiento para la reparación del esterilizador. este no puede ser colocado nuevamente en servicio hasta que se hagan las operaciones de verificación. • Todo el personal hospitalario debe revisar los paquetes estériles en forma rutinaria, y ordenarlos en los estantes según la fecha de vencimiento. Se deben colocar los objetos con menor fecha de caducidad adelante. si la fecha de vencimiento ha caducado, el paquete debe ser removido del servicio y enviado a la ce para su reprocesamiento. esto es responsabilidad de cada departamento. Responsabilidad
- 4. La calidad es una herramienta básica para la mejora de los procesos y servicios. las normas ISO 9001 (calidad general) y en ISO 13485 (calidad para instalación y mantenimiento de productos sanitarios) nos permiten evaluar nuestro sistema y dirigir los pasos de nuestra mejora. En el caso de la esterilización, debe asegurar un adecuado nivel de esterilización (SAL: Sterilization Assurance Level - Nivel de garantía de esterilización) para que el proceso específico genere un producto o servicio de acuerdo con su especificación predeterminada y en conformidad con las características de calidad establecidos. La Norma Europea, 1994, define que: un dispositivo médico para que sea denominado “estéril”, debe alcanzar un SAL de 10-6 cuando es sometido a un proceso validado. VALIDACIÓN DEL PROCESO DE ESTERILIZACIÓN
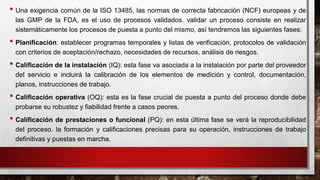
- 5. • Una exigencia común de la ISO 13485, las normas de correcta fabricación (NCF) europeas y de las GMP de la FDA, es el uso de procesos validados. validar un proceso consiste en realizar sistemáticamente los procesos de puesta a punto del mismo, así tendremos las siguientes fases: • Planificación: establecer programas temporales y listas de verificación, protocolos de validación con criterios de aceptación/rechazo, necesidades de recursos, análisis de riesgos. • Calificación de la instalación (IQ): esta fase va asociada a la instalación por parte del proveedor del servicio e incluirá la calibración de los elementos de medición y control, documentación, planos, instrucciones de trabajo. • Calificación operativa (OQ): esta es la fase crucial de puesta a punto del proceso donde debe probarse su robustez y fiabilidad frente a casos peores. • Calificación de prestaciones o funcional (PQ): en esta última fase se verá la reproducibilidad del proceso. la formación y calificaciones precisas para su operación, instrucciones de trabajo definitivas y puestas en marcha.
- 6. El proceso de validación consiste en comprobar de forma certificada y suficientemente documentada que un proceso cumple con los requisitos para los que fue diseñado. en el caso de la esterilización, etiquetar un producto sanitario con la palabra “estéril” es solamente permisible cuando se ha utilizado un proceso de esterilización validado. por lo tanto, la validación debería constar de los siguientes puntos: • Calificación de la instalación • Calificación de funcionamiento • Calificación de proceso • Documentación • Cálculo de letalidad • Informe de validación y certificados Validación del proceso de esterilización
- 7. Es importante validar el proceso en todos sus puntos: lavado, carga/descarga del material, así como el proceso de esterilización propiamente dicho. en el caso de las cargas/descargas del material la validación de este procedimiento consiste en cumplir etapas y criterios mínimos de evaluación que el usuario debe manejar. Técnica y material Es la evidencia documentada que aporta un alto grado de seguridad de este proceso en el que se tendrá en cuenta los siguientes aspectos: • Posición de los artículos dentro de la carga. • Empaque de la carga. • Ciclo elegido. • Cómo descargar. • Repetir tres veces. Validación de las cargas
- 8. AUDITORIA demuestra, documenta y verifica que los equipos cumplen con las especificaciones de funcionamiento diseñadas luego de su instalación en el lugar de uso. CERTIFICACIÓN DE FUNCIONAMIENTO Demuestra que el equipo, luego de su revisión producirá productos aceptables cuando son operados de acuerdo a las especificaciones del proceso. en ello se tendrá que demostrar: Componentes de la validación de la esterilización
- 9. •Certificación del equipamiento. •Prueba de eficacia del equipamiento. •Monitorización de la rutina de operación de los equipos. •Validación si se identifica una alteración de la rutina.
- 10. •Ambiente •Calidad Del Equipo •IQ Calidad De Instalación •OQ Calidad De Operación •PQ Calidad De Proceso Validación del proceso de esterilización por calor seco, por vapor, oxido de etileno
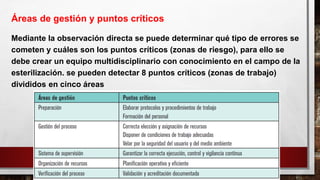
- 11. Mediante la observación directa se puede determinar qué tipo de errores se cometen y cuáles son los puntos críticos (zonas de riesgo), para ello se debe crear un equipo multidisciplinario con conocimiento en el campo de la esterilización. se pueden detectar 8 puntos críticos (zonas de trabajo) divididos en cinco áreas Áreas de gestión y puntos críticos
- 12. • Formar un equipo multifuncional para validación • Planear el enfoque y definir los requerimientos • Identificar y describir los procesos • Especificar los parámetros de proceso y el resultado deseado • Crear un plan maestro de validación • Seleccionar los métodos y herramientas para validación • Crear protocolos de validación • Llevar a cabo iq, oq, pq y documentar los resultados • Determinar controles de procesos continuos • Preparar el informe final y asegurar la aprobación de la administración • Controlar el proceso de manera continua Resumen de las actividades de validación
- 13. INDICADORES DE CALIDAD DE LA CENTRAL DE ESTERILIZACIÓN El proceso de esterilización debe ser efectivo, neutralizar cualquier forma de vida, y se ha de verificar en el correcto resultado de los indicadores físicos, químicos o biológicos. Criterio de verificación de la efectividad del proceso de esterilización Indicadores
- 14. REUSO DE DISPOSITIVOS MÉDICOS DE UN SOLO USO •Hoy día se entiende por reuso: al uso repetido de cualquier dispositivo médico, incluyendo aquellos reusables o rotulados para único uso, con el correspondiente reprocesamiento, entre usos. se entiende por reprocesamiento: a todas las operaciones necesarias para reusar materiales reusables o materiales de un solo uso contaminados. los pasos incluyen: limpieza, testeo funcional, empaque, rotulado y esterilización.
- 15. Según la FDA, los dm de un solo uso se clasifican en: •Clase I o bajo riesgo: dispositivos que se consideran que presentan bajo riesgo para los pacientes. estos requieren “controles generales”. •Clase II o de mediano riesgo: dispositivos que pueden poseer algún riesgo para los pacientes y por lo que necesitan “controles especiales”. •Clase III o de alto riesgo: productos que se consideran que presentan alto riesgo para los pacientes. estos requieren “controles rigurosos”.
- 16. Por lo tanto, los requisitos que se deben cumplir para reusar dispositivos médicos de un solo uso son: LIMPIEZA: el diseño y la fabricación de un dispositivo debe permitir la limpieza de todas las superficies. Definiéndose a la limpieza como la remoción total de toda suciedad visible de las superficies, hendiduras, juntas y lúmenes del dispositivo. INSPECCIÓN: luego de la limpieza deben poder realizarse pruebas de funcionalidad y de integridad física para verificar que resulta seguro para ser reusado. El nivel de inspección dependerá de la complejidad del dispositivo y de su uso posterior. El proceso de inspección puede ser, por un simple chequeo visual, para asegurar que toda suciedad visible se eliminó, y/o por un proceso complejo que requiera el equipamiento adecuado. EMPAQUE: debe lograrse la misma calidad de empaque que la del producto original, teniendo en cuenta el proceso de esterilización que posteriormente sufrirá. ESTERILIZACIÓN: el proceso de esterilización debe demostrar un coeficiente de seguridad de la esterilidad (CSE) de 10-6, ya que es el coeficiente aceptado para los dispositivos que tomarán contacto con tejido. El óxido de etileno es el esterilizante más comúnmente utilizado para productos termosensibles, de todas formas deberían evaluarse todas las alternativas que se poseen.
- 17. La validación de los procesos en reuso de dm se realizarán a través de: • verificación de la efectividad de la limpieza. • verificación de la eficacia de los procesos de esterilización. • verificación de ausencia de residuos tóxicos. La verificación de ausencia de residuos tóxicos no es sencillo de realizar en los centros de salud. los centros más complejos realizarán el trabajo de desarrollo primario y luego darán esta información a los centros de baja complejidad. El costo de desarrollo de los protocolos puede reducirse si los hospitales colaboran cada uno en partes del mismo. Los resultados luego podrán aplicarse para aquellos dispositivos del mismo fabricante, duplicando los procedimientos y con el mismo equipo esterilizador, funcionando bajo las especificaciones del fabricante Validación de los procesos en reuso de materiales
- 18. Como último paso para el diseño del protocolo se deberá demostrar que el dm reprocesado es funcionalmente similar al dm original. La prueba se debe dirigir a verificar las características específicas del dm por ej.: si un dm requiere poseer la propiedad de flexión durante su uso regular, una demostración de que soporta ser doblado sería importante. Integridad y funcionalidad de los DM
- 19. LIMPIEZA Y DESINFECCIÓN AMBIENTAL DE LA CENTRAL DE ESTERILIZACIÓN La limpieza y desinfección ambiental de la Central de Esterilización deberá realizarse diariamente. Al menos una vez por día se deberán limpiar los pisos y las superficies horizontales de trabajo. Otras superficies (estantes, techos, vidrios, paredes) se limpiarán periódicamente, de acuerdo al programa regular diagramado por el supervisor. Durante el procedimiento de limpieza, el personal debe tener mucho cuidado en no alterar la integridad de los envases y los materiales ya procesados. La limpieza se hará siempre desde las áreas “limpias” hacia las áreas “sucias”, a fin de evitar la transferencia de contaminantes. Es ideal contar con utensilios de limpieza (trapos, franelas, esponjas) diferenciados por áreas: sucia y limpia. El personal debe estar capacitado y entrenado para cumplir el protocolo estandarizado, teniendo en cuenta los siguientes aspectos:
- 20. • Efectuar los procedimientos de limpieza de manera exhaustiva, dando mayor énfasis a pisos y superficies donde la carga de suciedad y de microorganismos está más concentrada. • Las paredes deben estar libres de manchas y salpicaduras, y serán limpiadas completamente cuando presenten suciedad u hongos. • Se recomienda la utilización de aspiradores de agua para una mejor desinfección de los pisos, aunque no se cuenta con este equipamiento en la mayoría de las instituciones de salud. • Los materiales para la limpieza deben colocarse en carritos móviles, en los pasillos. • Nunca debe efectuarse el barrido en seco con escoba, pues se provoca el paso de microorganismos desde el suelo al aire, donde quedarán suspendidos por varios minutos hasta depositarse nuevamente en las superficies horizontales del área. • No se recomienda el uso de aspiradores de aire por la misma razón. • Tampoco deben sacudirse los trapos con polvo, ni deben limpiarse las superficies con trapos secos.
- 21. Procedimiento La limpieza y desinfección se llevará a cabo desde el área verde (la más limpia o estéril) al área azul, para finalizar en el área roja. Pisos • Método húmedo: que comprende dos técnicas, el uso de doble balde o el uso de un balde único. ➢ Procedimiento de doble balde: es el método más común y de elección. Se realiza con el sistema de dos baldes uno para la solución desinfectante o detergente y el otro con agua limpia para el enjuague. Con este método se minimiza la recontaminación de las áreas. ➢ Procedimiento de balde único: cuando se usa este método, la solución debe ser cambiada: 1) cuando esté sucia, aunque no se haya finalizado de limpiar el área, y 2) antes de pasar a otra área.
- 22. Superficies • Todos los estantes deben ser limpiados semanalmente con un paño limpio y alcohol al 70%, para quitar el polvo. En ese momento, todos los equipos médicos estériles deben ser revisados por fecha de vencimiento y por la integridad del paquete. • Se utilizará un paño o trapo tratado con desinfectante, que puede ser hipoclorito de sodio (1:100), para limpiar las superficies. Para cada área se utilizará un trapo limpio. • Alternativamente, se pueden rociar las superficies con la solución de hipoclorito de sodio, diluido 1:100, y luego se frotarán vigorosamente con un trapo limpio saturado en la solución.
- 23. RIESGOS LABORALES • El equipo de salud que trabaja en un establecimiento hospitalario se encuentra expuesto a innumerables riesgos capaces de provocar alteraciones o patologías laborales. • Los servicios de esterilización no son una excepción para la ocurrencia de riesgos laborales. por el contrario, podemos decir que constituye un área de trabajo que conlleva un alto riesgo laboral. • Los riesgos pueden ser de distinta naturaleza o etiología, siendo los más comunes:
- 24. •RIESGOS FÍSICOS: son los causados por los equipos, cuyo uso entraña riesgos tales como el ruido y vibraciones provocando trauma sonoro y altas temperaturas que pueden provocar quemaduras. •RIESGOS QUÍMICOS: provocados por aerosoles, gases, vapores y los polvos orgánicos que pueden ser naturales o sintéticos e inorgánicos. los agentes esterilizantes químicos con mayor riesgo son: el óxido de etileno, el glutaraldehído, el ácido peracético, el peróxido de hidrógeno y el formaldehído. •RIESGOS BIOLÓGICOS: provocados por la presencia de microorganismos (hongos, virus, bacterias, etc.). •RIESGOS ERGONÓMICOS: son aquellos directamente ligados al diseño de los equipos, al estrés, cargas de trabajo, fatiga, trabajos repetitivos, monotonía, etc.
- 25. GRACIAS….